在上篇中,研究人员基于自由能微扰(FEP+)技术,成功识别出全新且独特的高活性MALT1抑制剂系列(即三环脲类化合物系列)。接下来就需要对其进行活性提升了。
在这个化合物系列中,化合物2在MALT1生化实验中表现出强效抑制活性,且在BCL10细胞水平靶点结合实验和CTG细胞活力实验中也展现出良好的细胞活性。化合物2在小鼠和人肝微粒体中稳定性良好,在CD-1小鼠中具有口服生物利用性(如下表)。
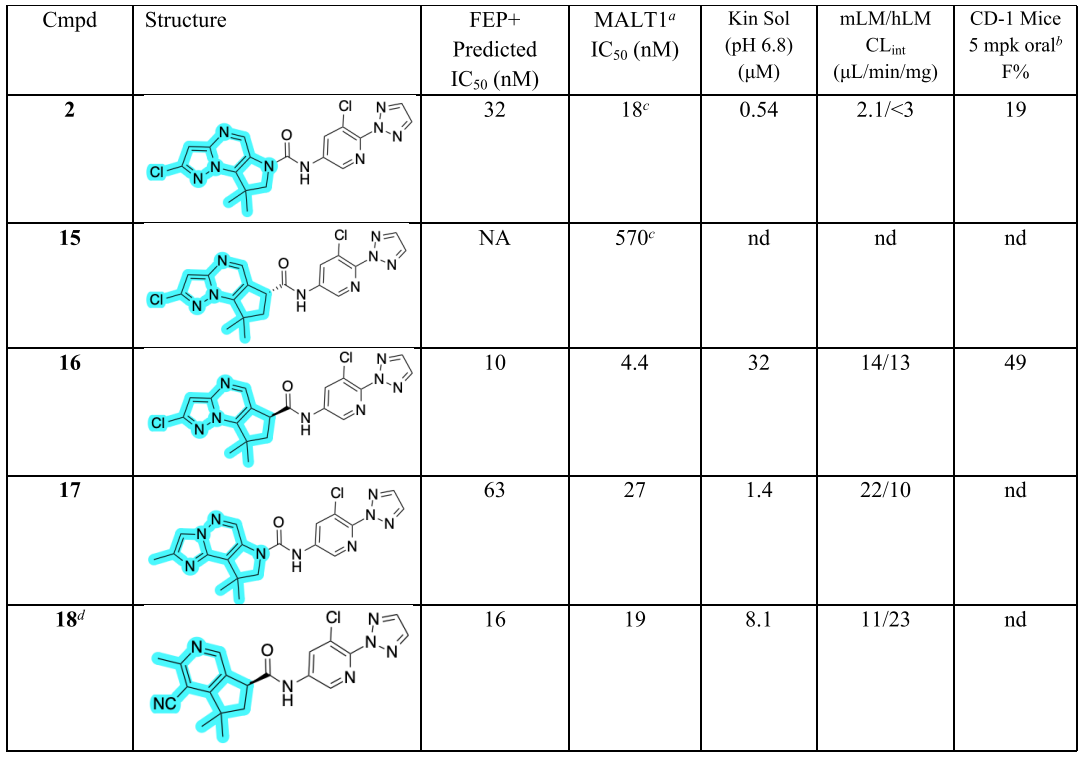
![]()
图注:多种环状脲或酰胺类似物的SAR
为进一步提升活性,研究团队首先针对化合物2中偕二甲基取代基(R1和R2)周围的小型疏水口袋展开结构修饰探索(如下表)。通过FEP+模型对约300个不同R1和R2取代的设计方案进行评估后,基于FEP+的活性预测结果,筛选出排名前10的化合物进行合成。
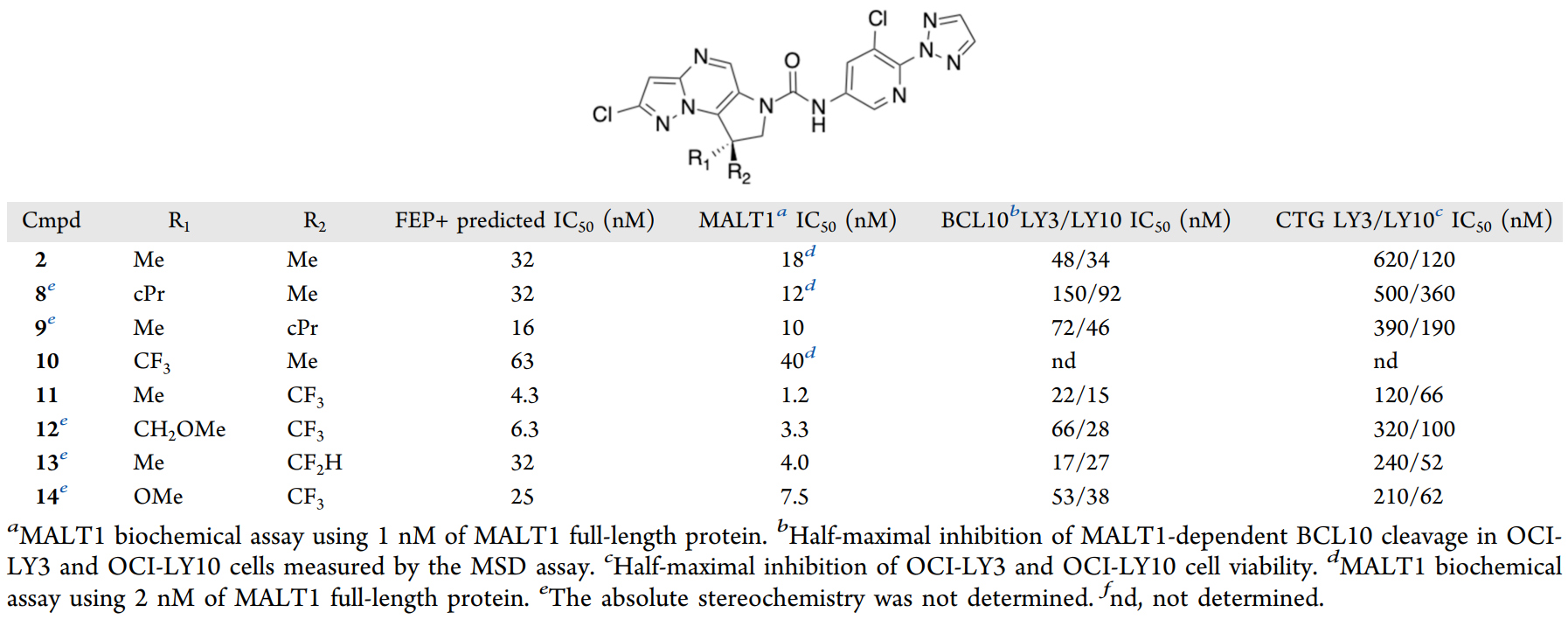
图注:二氢吡咯环上取代基的SAR
FEP+模型预测化合物11可达到理想的个位数纳摩尔级活性。虽然在季碳原子中心引入三氟甲基(CF3)存在合成挑战,但FEP+模型的预测精准性为此提供了信心。实验结果不出所料,化合物11的MALT1抑制IC50为1.2nM,与FEP+的预测结果高度吻合,且相较于化合物2,其活性显著提升了10倍。
FEP+模型还正确预测出R型对映异构体(化合物11)的活性高于S型对映异构体(化合物10)。化合物11与MALT1形成复合物的共晶结构(如下图)证实了其绝对构型,相比之下,化合物10中较小的甲基(CH3)在该口袋中形成的疏水相互作用较弱,导致三氟甲基部分暴露于溶剂中。
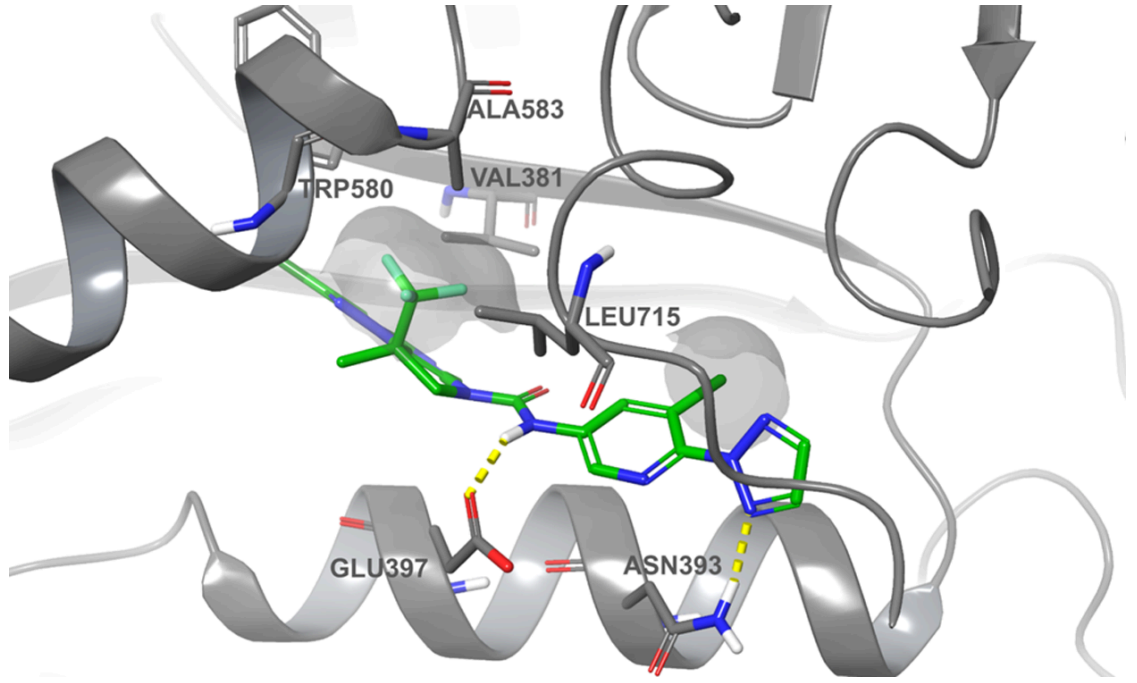
图注:化合物11与MALT1形成复合物的共晶结构(PDB编号:9MKE)
总之,化合物11在生化实验和细胞水平实验中均为强效MALT1抑制剂,且具有良好的体外药物吸收、分布、代谢和排泄(ADME)特性,在CD-1小鼠中表现出较好的口服生物利用度。因此,化合物11成为这个项目的先导化合物。
除探索疏水口袋以提升活性外,研究团队还同步开展了两项优化:一是将二氢吡咯环的氮原子替换为手性碳原子;二是针对Core 1,设计多种单环或双环系统的结构方案。在完成Core 1和连接链(Linker)区域的优化后,研究团队启动了Core 2的探索,旨在进一步改善化合物11的理化性质,重点是在平衡渗透性的同时提升溶解度。
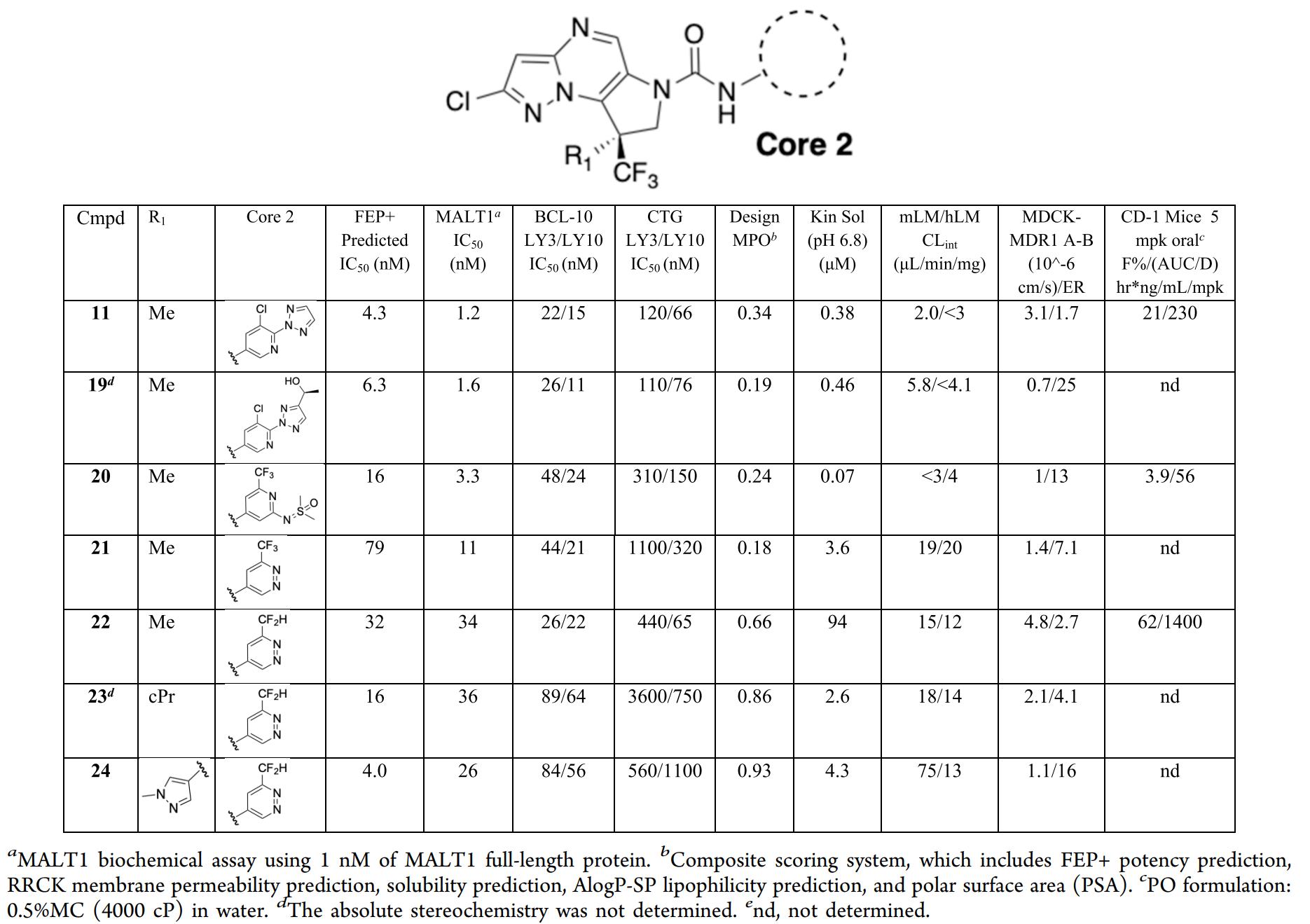
图注:Core 2的SAR
通过Schrödinger平台的AutoDesigner在严格校准的理化性质范围内进行枚举,研究团队共生成了约11亿个设计方案。计算流程通过核心替换,对广阔的化学空间进行快速探索。对于通过筛选的设计方案,采用核心约束对接法评估其与结合口袋的适配性。最后,通过迭代式主动学习FEP+方法,对对接后的设计方案进行活性预测评分。该流程共筛选出约1000个设计方案。
其中,研究人员采用AlphaFold2构建了C端的结构模型。该模型与现有晶体学数据结合后形成的混合模型显著提升了Core 2区域FEP+预测的准确性,为化学结构设计决策提供了有力支持。
后续的先导化合物优化过程也是充满挑战的,研究团队采用了多参数优化(MPO)综合评分体系进行了FEP+活性预测及体外ADME性质预测。详情敬请关注下一篇。
参考资料
1. Nie, Zhe et al. “Accelerated In Silico Discovery of SGR-1505: A Potent MALT1 Allosteric Inhibitor for the Treatment of Mature B-Cell Malignancies.” Journal of medicinal chemistry, 10.1021/acs.jmedchem.5c01494. 13 Oct. 2025, doi:10.1021/acs.jmedchem.5c01494
2. A Phase 1 study of SGR-1505, an oral, potent, MALT1 inhibitor for relapsed/refractory (R/R) B-cell malignancies, including chronic lymphocytic leukemia/small lymphocytic leukemia (CLL/SLL). Spurgeon, et al. European Hematological Association Annual Congress. 2025.
3. Hit to development candidate in 10 months: Rapid discovery of SGR- 1505, a novel, potent MALT1 inhibitor, Schrödinger



