

PINNACLE 21 ENTERPRISE
企业级解决方案构建以确保CDISC合规性: FDA批准的先决条件
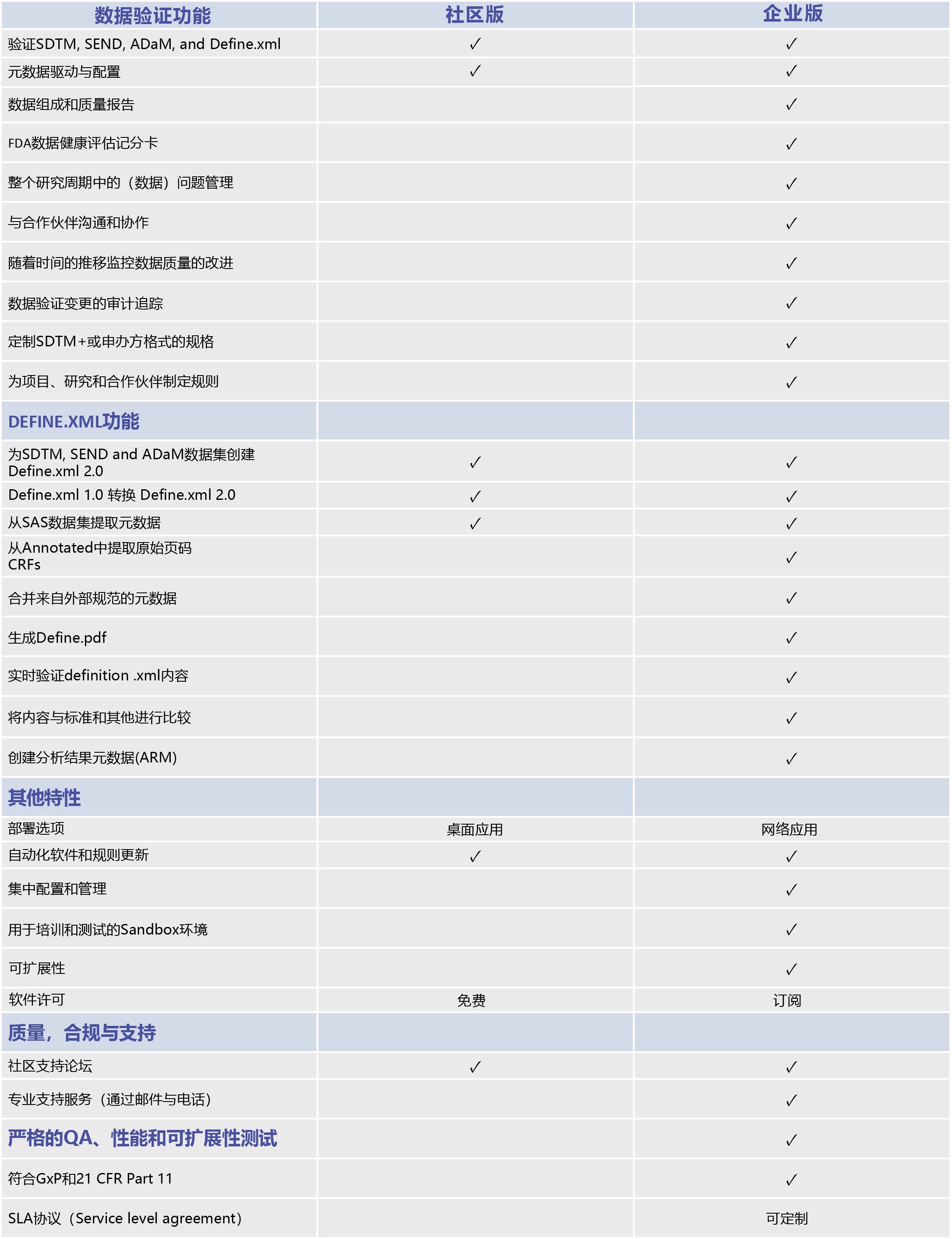
1. 验证计分卡
通过查看数据质量、标准遵从性等方面的通过/失败列表,准确地知道要处理什么。
2. 问题整理
通过我们的直观界面查看、组织和标记各种数据问题,并能快速添加注释和分配任务。
3. 问题管理
与CROs、开发人员和其他人沟通和协作,通过系统简便的信息沟通工具及时解决问题。
4. 变更审计追踪
生成并审查一份简单的审计追踪报告,详细说明自上次验证数据以来发生了哪些变化。
5. 验证历史记录
一个简单的点击,即可创建一个图表,显示随着时间推移的数据质量,以确保你在正确的方向上移动。
6. DEFINE.XML 2.0设计器
为SDTM、ADaM、SEND和遗留数据集创建definition .xml 2.0,并轻松地将definition .xml 1.0文件转换为definition .xml 2.0。
7. 定制域
轻松定制您的数据集,以支持接近CDISC标准:如SDTM+或申办方定义的格式。
8. 自定义规则
通过我们易于使用的用户界面定制规则,以满足您的特定需求,并在企业范围内共享它们。
看下哪个版本的PINNACLE 21 适合您的企业
关于 PINNACLE 21
想知道Pinnacle 21是什么,我们就必须从临床数据交换标准协会(CDISC)说起。临床递交的频次逐年增加,对临床数据递交和审核的效率提出了更高的要求,而且有些赞助商和项目有特殊的标准,如何去有效的将内部标准和监管机构无缝协同沟通,也是一个巨大的挑战。
2000年,32家跨国公司为了最优化来自医学研究全体成员的实践和理念,开始着手建立一系列标准。这些公司也成为CDISC 的缔造者。由此创建了这个日臻完善,全球性的非盈利组织,用于支持临床及临床前数据的电子获取、交换、递交、审核和归档。不过这个标准探索和制定的过程是漫长的,这个过程中FDA和整个生物制药行业都在为非标准化的数据深深苦恼。直到2007 年底和 2008 年初, CDISC才取得了突破性的进展,慢慢的,CDISC 开始塑造整个行业,CDISC标准为组织数据提供了一致的通用框架,包括数据集模板、变量的标准名称、确定适当的受控术语和使用公共变量进行计算的标准方法,后续逐步完善和升级,逐步变成了现在我们使用CDISC标准最终形态。
刚开始与CDISC数据管理和验证的可用软件并不多,一些通用性的工具需要通过编程来适应特定的任务,对用户层级要求比较高。2008 年10 月,Open CDISC Validator 是靠前推出的免费产品,旨在帮助开发人员创建符合FDA 标准的 SDTM 数据集。随着业界的热烈讨论,Open CDISC Validator 在研发人员中广受欢迎,后续ADaM 、SEND 和Define.xml等其他CDISC标准也逐步加入。2010年,Open CDISC Validator获得FDA的认可,热度一路飙升,Open CDISC Validator也是后来我们熟知的“Pinnacle 21 Community”的前身。
但是Validator 有一些限制,首先,拥有许多专业人员和多项研究的大型组织需要一个强大的集中式系统和更好的支持选项的平台;其次,由于Validator是免费工具,无法充分满足这一部分需求。2011 年 8 月,为了克服这些缺点,成立了 Open CDISC 的商业部门,称为“Pinnacle 21”。
2021年10 月,Pinnacle 21被生物模拟和监管科学的全球 Certara, Inc.(纳斯达克代码:CERT)成功收购,Pinnacle 21正式加入Certara大家庭。Pinnacle 21的软件工具用于验证提交数据集是否符合CDISC标准,该标准也是美国FDA、日本PMDA以及中国NMPA等主要国家和地区药监和评审机构的标准。