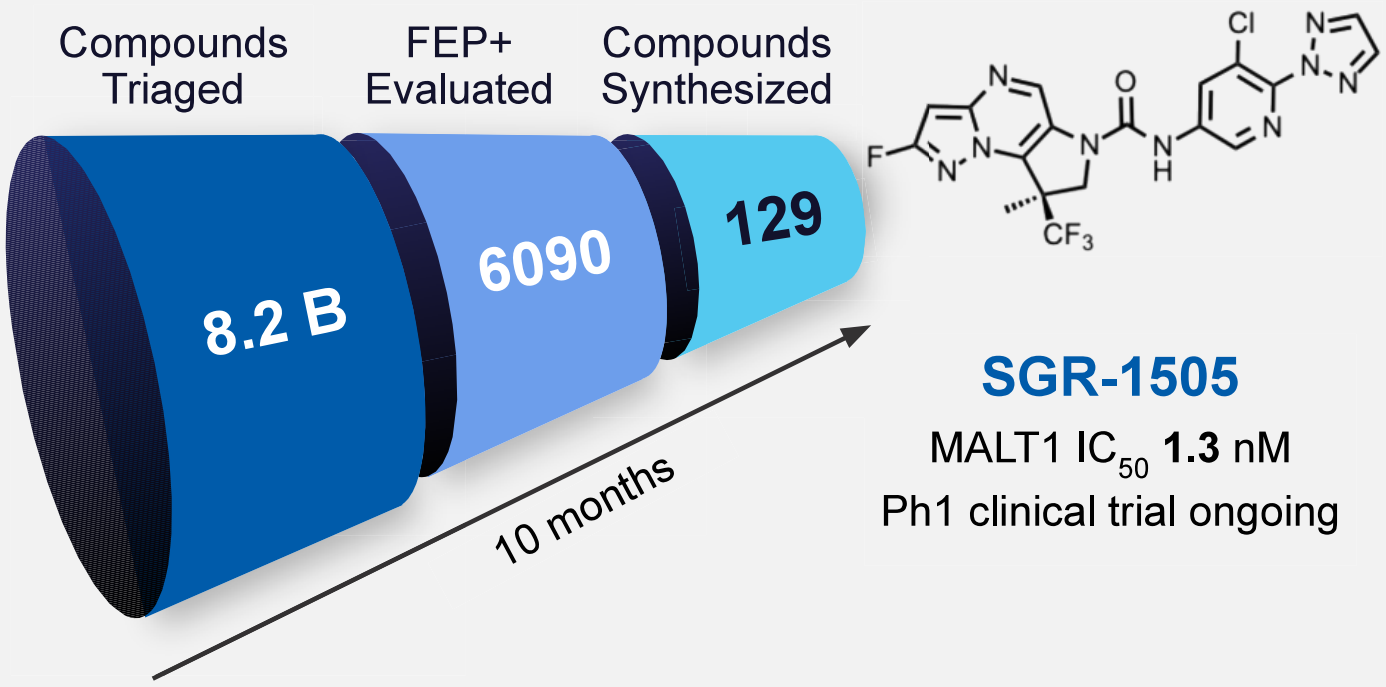
在上篇中,研究人员通过先进的基于物理学的FEP+建模技术,快速确定出新型活性化合物系列。在中篇中,应用FEP+技术对化合物活性进行了提升。接下来,多参数优化助推了候选药物SGR-1505的诞生。
1、FEP+指导多参数优化
在先导化合物优化阶段,研究团队采用了MPO综合评分体系进行了FEP+活性预测及体外ADME性质预测。体外ADME性质预测包括:RRCK膜渗透性(通过RRCK Membrane Permeability Workflow完成)、溶解度(通过Solubility FEP+ Workflow或机器学习模型预测)、亲脂性(通过AlogP-SP LogD模型预测)和极性表面积(PSA)。
通过FEP+和计算机辅助MPO驱动的大规模Core 2评估,研究团队发现了多个具有研究价值的Core 2类似物。虽然总体而言,Core 2探索过程没有发现整体性质优于化合物11(中篇中提及的先导化合物)的化合物,但这一步骤仍然至关重要,因为它确保了在广泛的化学空间内不遗漏任何高价值的类似物。
先导化合物优化是一个极具挑战性的过程,在这个阶段系统地应用FEP+活性预测和MPO设计方法,有助于发现整体性质均衡的分子。
研究团队尝试对吡唑并嘧啶Core 1进行进一步优化,针对63个设计方案进行FEP+评估,并根据FEP+活性预测结果筛选出10个方案进行合成,部分化合物的数据如下表所示。
图注:吡唑并嘧啶核心的取代基探索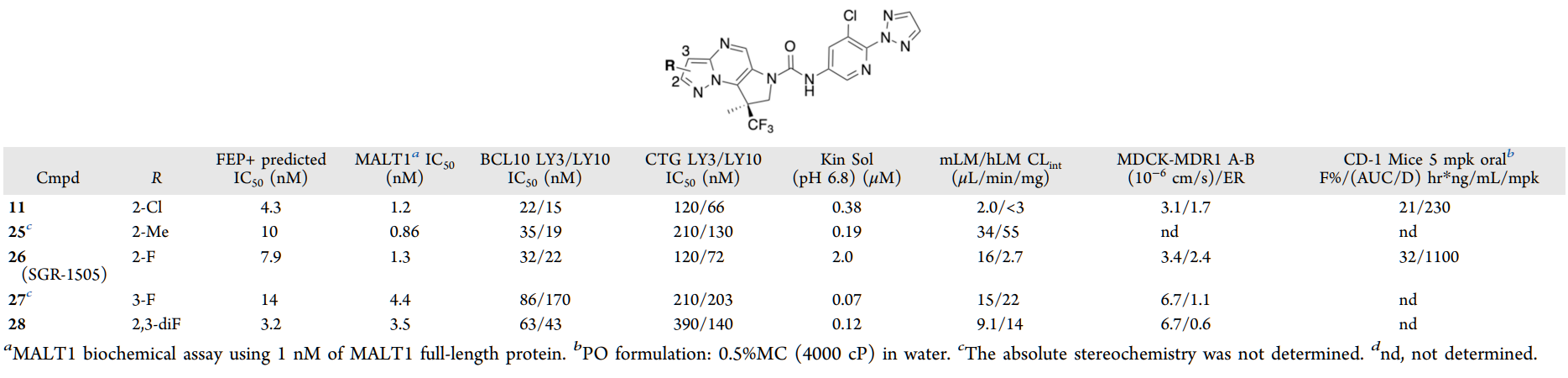
其中,化合物26表现出强效的MALT1生化抑制活性、BCL10靶点结合细胞活性及CTG细胞活力抑制活性,并具有良好的MDCK-MDR1渗透性、低外排率及优异的肝微粒体稳定性和冷冻保存肝细胞稳定性。 凭借优良的整体体外ADME特性,化合物26在啮齿动物中的口服暴露量显著优于化合物11,其在CD-1小鼠中的口服生物利用度和剂量标准化AUC均有所提升(如上表)。最终,化合物26被选定为研发候选药物,命名为SGR-1505。 理化性质优化的目的是快速筛选出满足目标产品特征(TPP)的分子。研究人员采用基于溶解度、渗透性和活性的预测模型MPO评分体系,评估了超过数千个设计方案,最终筛选出少数化合物进入合成与实验测试阶段,大幅降低了研发成本与时间。
2、FEP+活性预测的性能
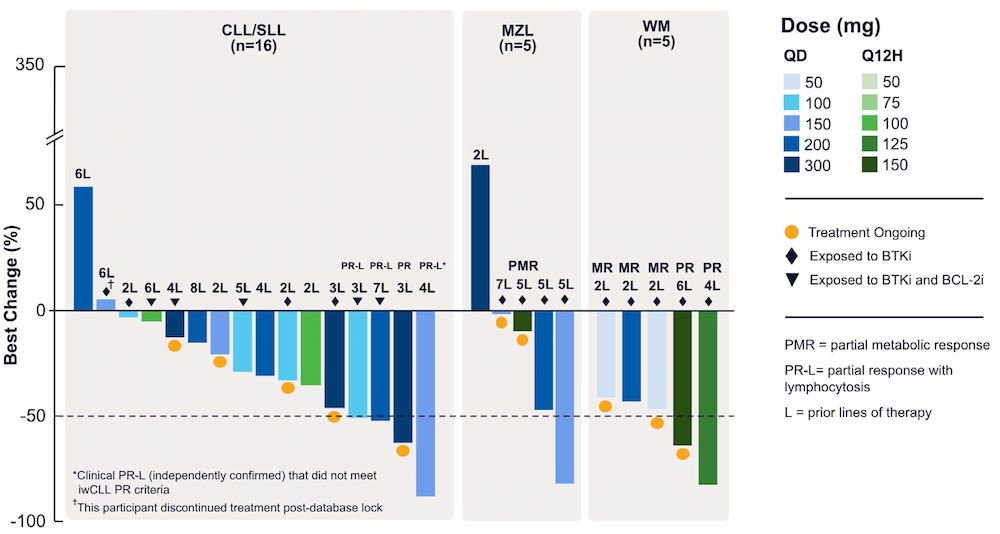
获取基于FEP+的可靠的活性预测模型,是发现SGR-1505的关键。在整个项目过程中,研究人员通过FEP+对超过6000个化合物进行了活性分析。下图展示了约130个已合成并完成检测的化合物的FEP+预测误差分布情况。
图注:FEP+的MALT1活性预测误差分布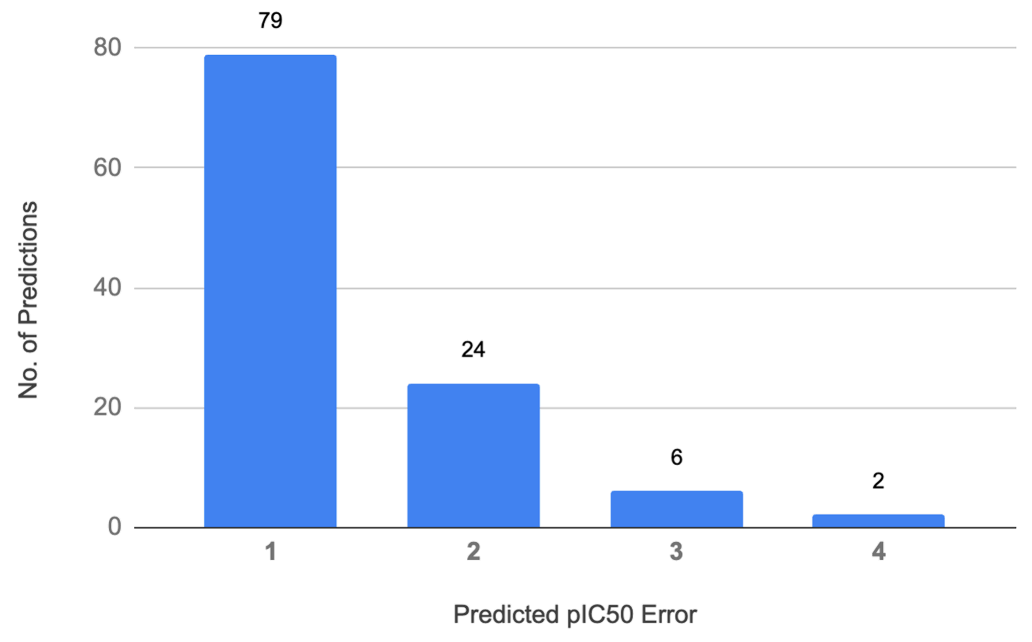
结果显示,大部分预测值与实验结果的偏差在1个pIC50单位以内,所有前瞻性预测的平均绝对误差(MUE)为0.9个pIC50单位。少数预测与实验结果偏差较大,它们大多与Core 2区域的结构扰动有关,该区域中蛋白质C端的大部分结构尚无明确解析。 3、SGR-1505的后续开发 在多种B细胞淋巴瘤体内异种移植模型中,SGR-1505单独使用或与BTK抑制剂联合使用时,均表现出强大的抗肿瘤活性。目前,SGR-1505已进入针对成熟B细胞肿瘤患者的1期临床试验(临床试验登记号:NCT05544019),预计于2026年3月完成。 2025年6月,这项临床试验发布的结果显示,该药物具有良好的安全性特征且耐受性良好,在复发/难治性B细胞恶性肿瘤患者中展现出令人鼓舞的初步疗效。在多种B细胞恶性肿瘤中均观察到治疗应答,包括慢性淋巴细胞白血病(CLL)和华氏巨球蛋白血症(WM)(如下图)。 图注:SGR-1505 1期研究的初步结果 总之,SGR-1505项目通过计算机辅助药物设计(CADD),采用严格的物理建模、机器学习、预测性ADMET模型(药物吸收、分布、代谢、排泄和毒性预测模型)及数据分析,高速且精准地搜索并筛选了超过80亿个化合物,成功识别出性质优越的新分子,大大缩短了药物开发的周期。 图注:FEP+助力候选药物开发的各个阶段