在之前的推文中,研究人员借助计算模拟工具优选出3个母核(点击回顾苗头化合物发现过程)进行先导化合物优化,但咪唑并吡啶母核系列存在CYP3A时间依赖性抑制(点击回顾先导化合物优化过程)。
在认识到咪唑并吡啶母核的缺陷后,研究团队在FEP+技术指导下开展了全新的母核设计,目标是改变5-6元双环母核体系的电子性质,同时维持DLK抑制活性。基于计算模拟数据,吡唑并吡啶酮类化合物41(KAI-10634)不仅活性强,还具有良好的体外ADME特性,因此被选定用于进一步开发。
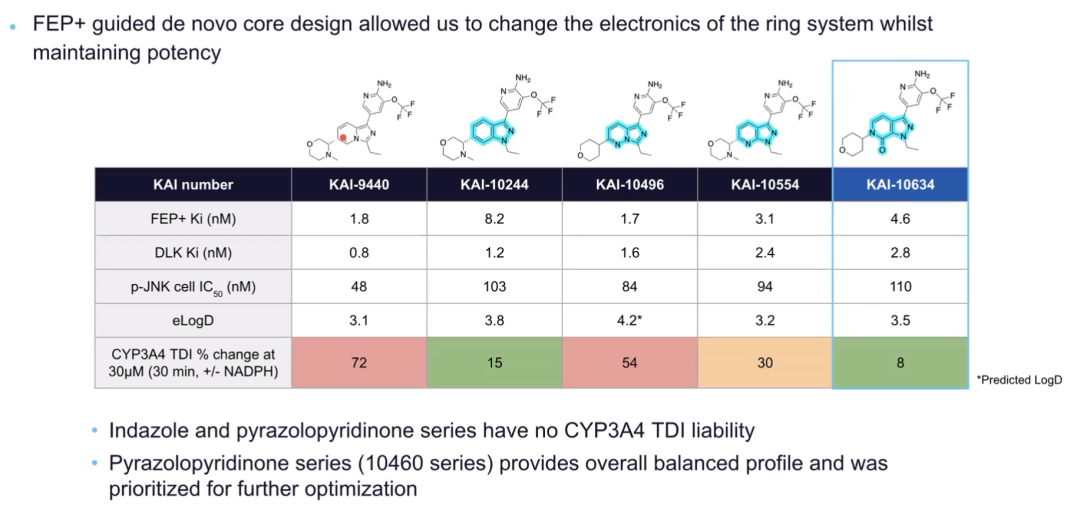
图注:识别无CYP3A4 TDI的系列
对于中枢神经系统激酶药物研发项目而言,核心挑战之一是实现足够的血脑屏障穿透能力,以确保靶点结合、展现药效并获得良好的安全窗。在前期阶段,研究团队已采用业界广泛认可的CNS预测指标指导化合物设计流程,包括Pfizer CNS MPO评分、Merck CNS MPO评分、极性表面积(PSA)及分子量(MW)。
此外,在将化合物推进至体内药代动力学实验前,研究团队还通过MDCK-MDR1体外筛选排除P-糖蛋白(P-gp)底物类化合物。然而,收集到的体内Kp,uu数据与所有的常用预测指标均无显著相关性(如下图)。
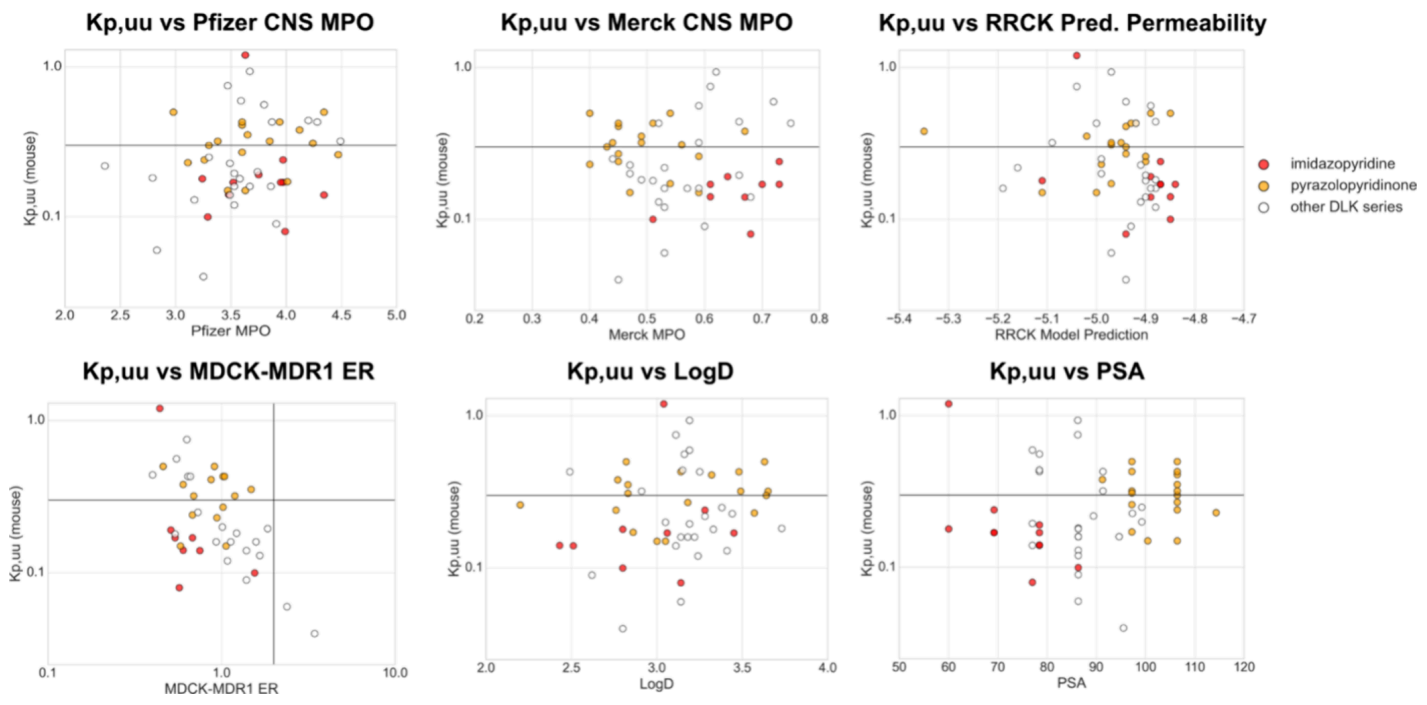
图注:通用的CNS指标与Kp,uu缺乏相关性
通过分析内部及公开的啮齿类动物脑药代动力学数据集,研究人员发现溶剂化能(E-sol,即energy of solvation)与Kp,uu存在强相关性。E-sol是基于量子力学(QM)计算得出的配体属性参数,可模拟配体在水相和真空相之间的分配行为。该参数综合考虑了分子三维构象、尺寸效应、气液分配特性、极性及配体的中和能(即pKa),涵盖了多个与血脑屏障穿透能力相关的固有属性。
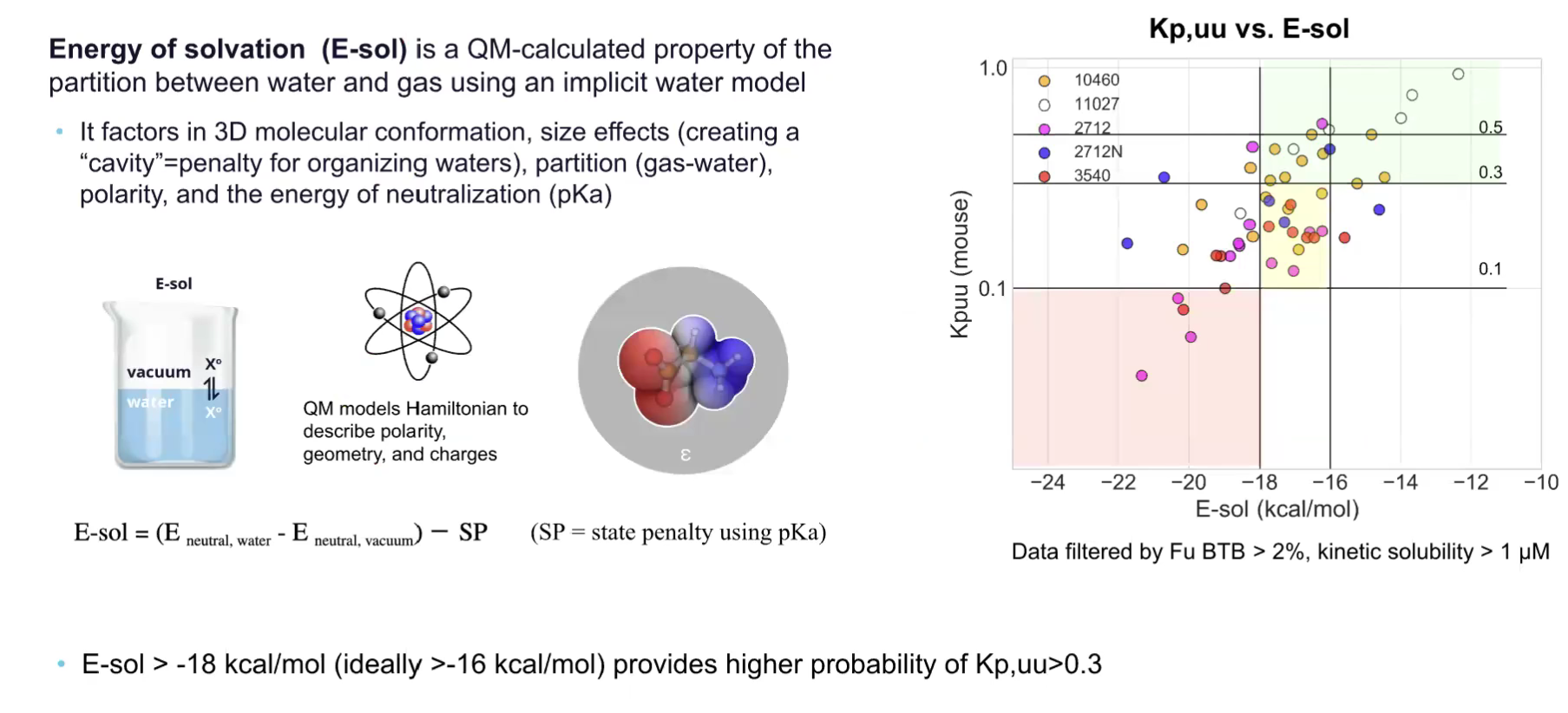
图注:E-sol预测与Kp,uu有良好的相关性
上方的散点图展示了53个不同系列DLK抑制剂的Kp,uu数据与E-sol预测值的关联,若以Kp,uu=0.3为目标值,将E-sol临界值设定为-17.1 kcal/mol,筛选富集效果良好,分类准确率达70%。
因此,在将研发重点转向吡唑并吡啶酮系列时,开始应用E-sol预测,以同时具备良好E-sol值和Kp,uu的化合物41(KAI-10634)为起始点开展先导化合物优化。并同时采用多种FEP模型,在提升化合物活性和选择性的同时,平衡吡唑并吡啶酮系列的ADME特性与PK谱。
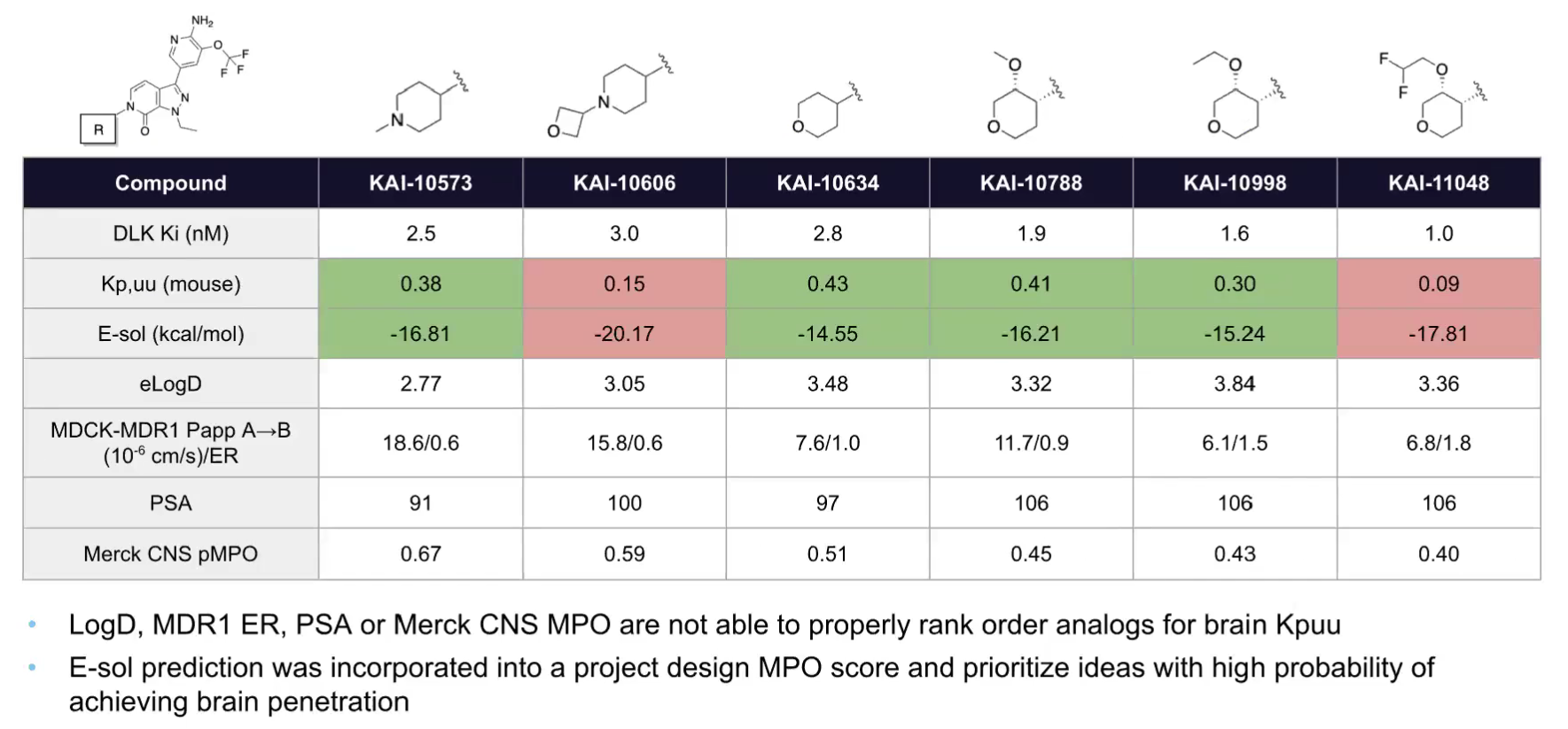
图注:E-sol预测用于指导脑渗透性DLK抑制剂的设计
为了大幅提升脱靶激酶的选择性,研究人员利用已有的X射线晶体结构或通过构建同源模型,为每种脱靶激酶建立了FEP模型。为简化前瞻性脱靶FEP谱分析流程并降低计算成本,基于序列相似性和实测活性相关性(R²>0.85),选择FLT3作为TRKA和KIT的替代激酶。
随后,对每个设计方案在体外针对LZK、MEK5、FLT3和PAK4进行前瞻性谱分析,建立了这4种脱靶激酶的FEP多参数优化(MPO)评分体系(如下图)。之后的实验测试验证了这些预测结果。
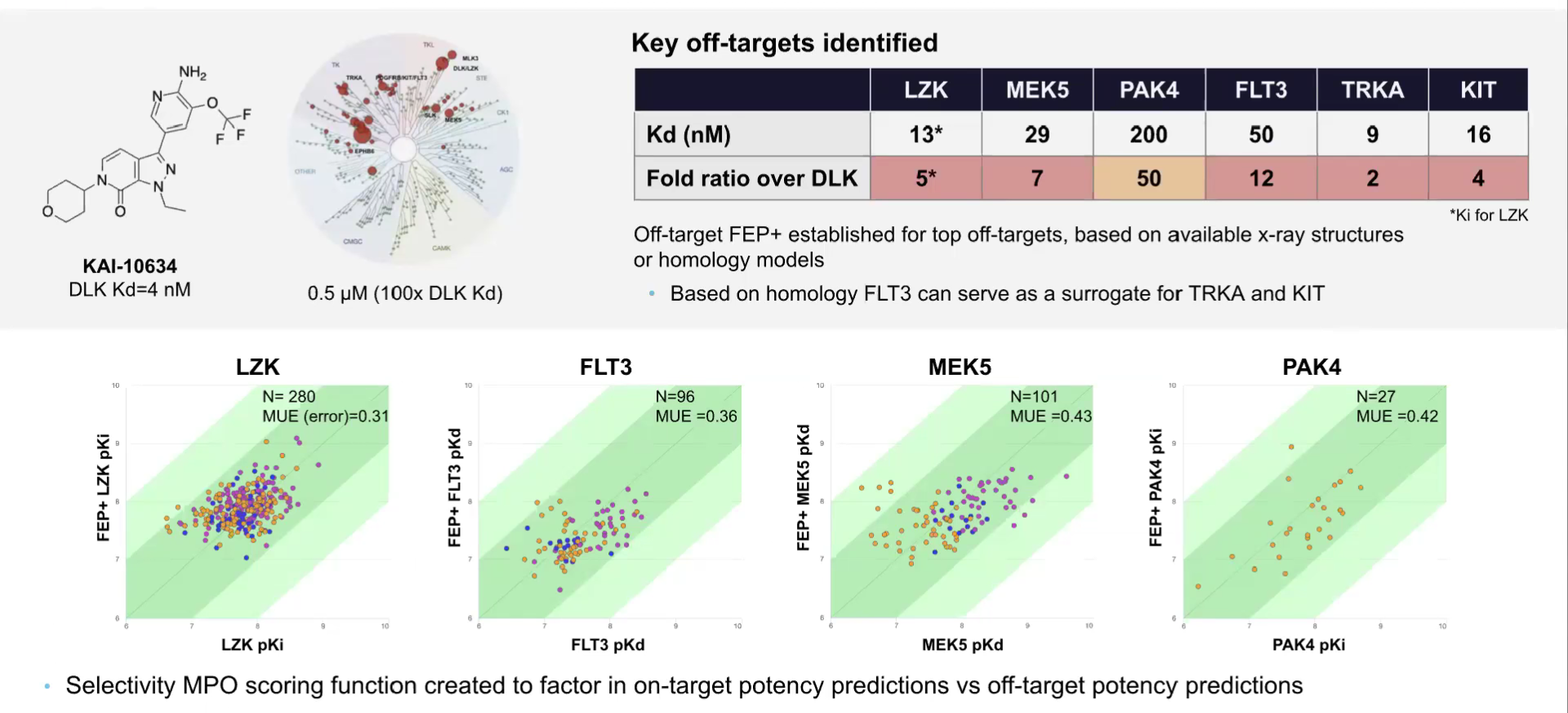
图注:通过脱靶FEP+提高激酶选择性
FEP选择性评分表明,在四氢吡喃基团上以顺式(S,S)构型引入手性甲氧基,有助于提升选择性。合成的顺式化合物51选择性优于母化合物41及其反式异构体50(如下图)。
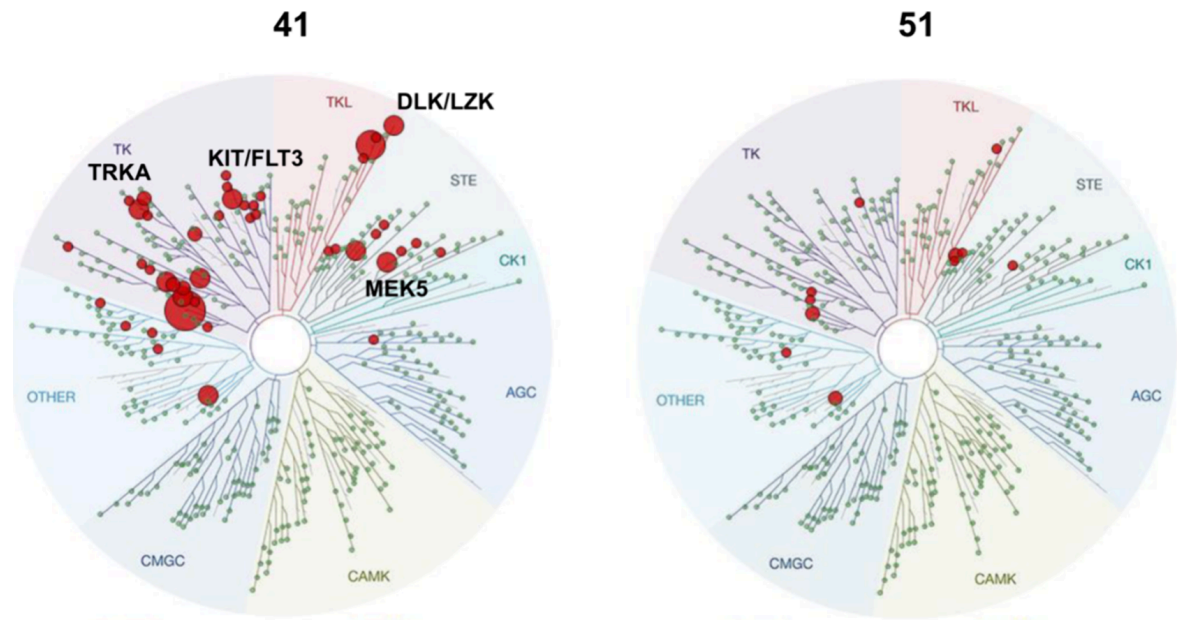
图注:化合物41和化合物51的选择性特征
化合物51与DLK的共晶结构(如下图)显示了该分子与DLK活性位点氨基酸残基的关键相互作用,其中吡唑并吡啶酮母核与谷氨酰胺(GLN197)之间形成的水网络尤为突出。THP基团上的手性甲氧基朝向活性口袋的P-loop溶剂界面,指向缬氨酸(VAL131)残基。
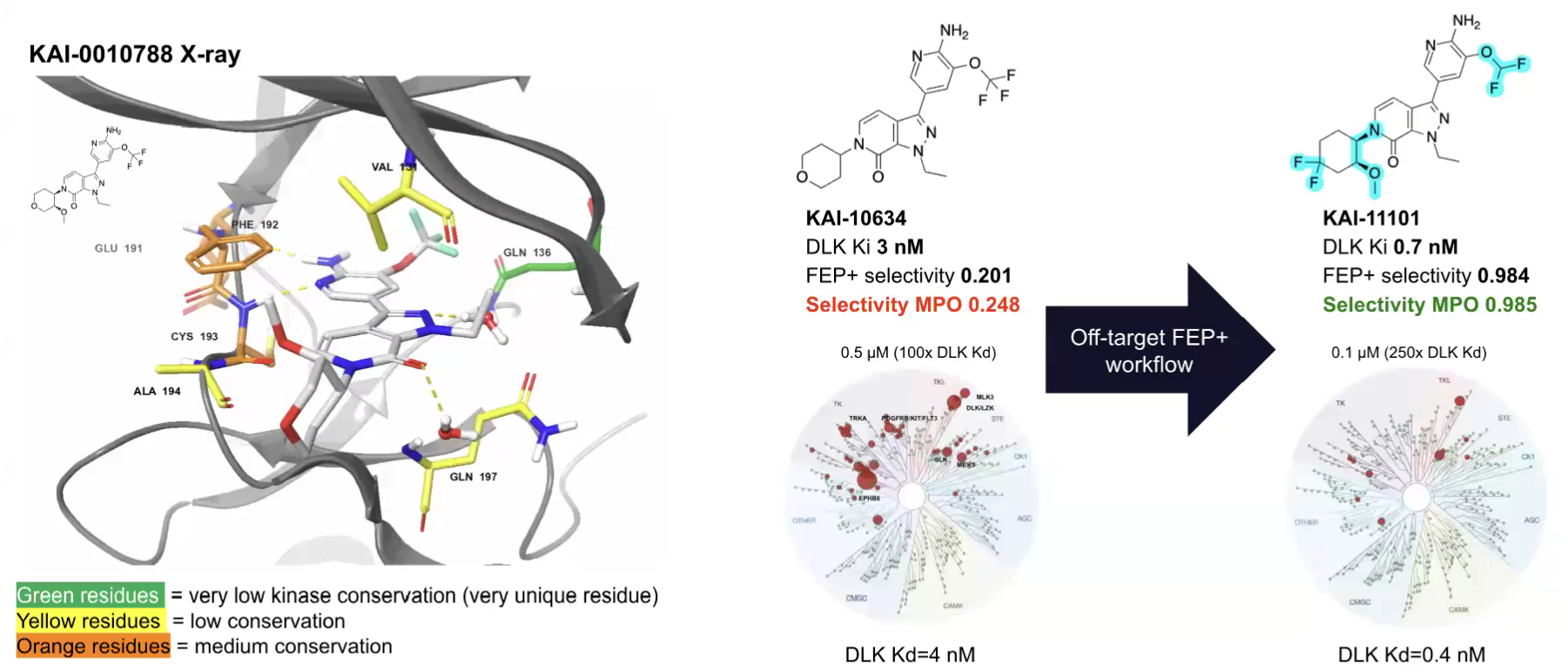
图注:两种化合物的选择性特征
总之,结合FEP活性预测、FEP选择性MPO评分及E-sol,筛选过程变得更加高效,成功识别出选择性提升且血脑屏障穿透能力良好的潜力化合物。
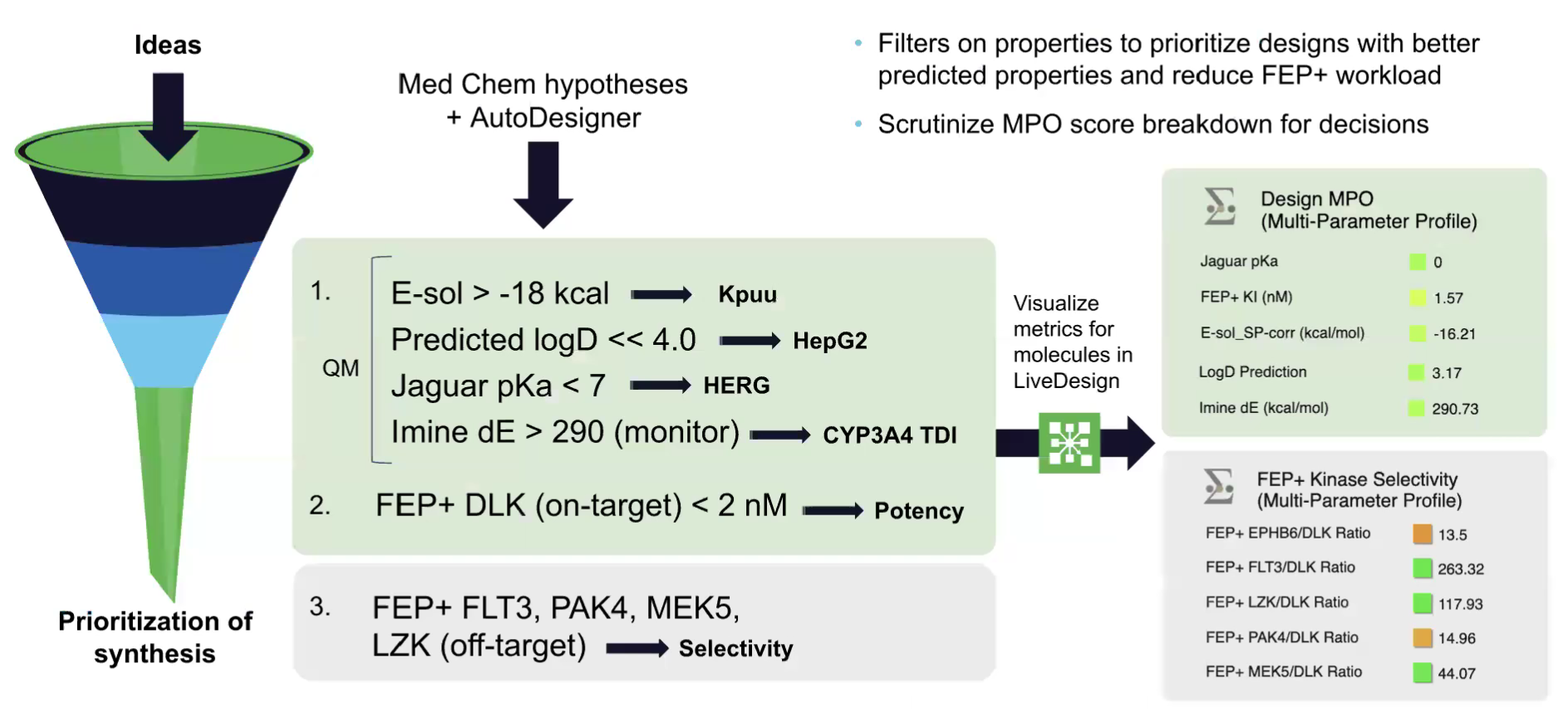
图注:DLK项目先导化合物优化过程中的数字化学工作流
实验结果显示,KAI-11101具有优异的体外安全性,在离体轴突断裂实验中表现出神经保护性,并在体内小鼠小脑帕金森病模型中显示出剂量依赖性的p-c-Jun减少(在肿瘤、炎症、神经退行性疾病等中,JNK通路常异常激活,p-c-Jun水平可作为疾病相关通路紊乱的佐证)。
总的来说,药物化学家和计算化学家通过密切的合作,借助Schrödinger的一系列工具成功预测出可以高效穿越脑血脑屏障的DLK抑制剂。可见,计算机辅助药物设计(CADD)能够结合物理学模拟和机器学习技术,更高效地进行新药发现。
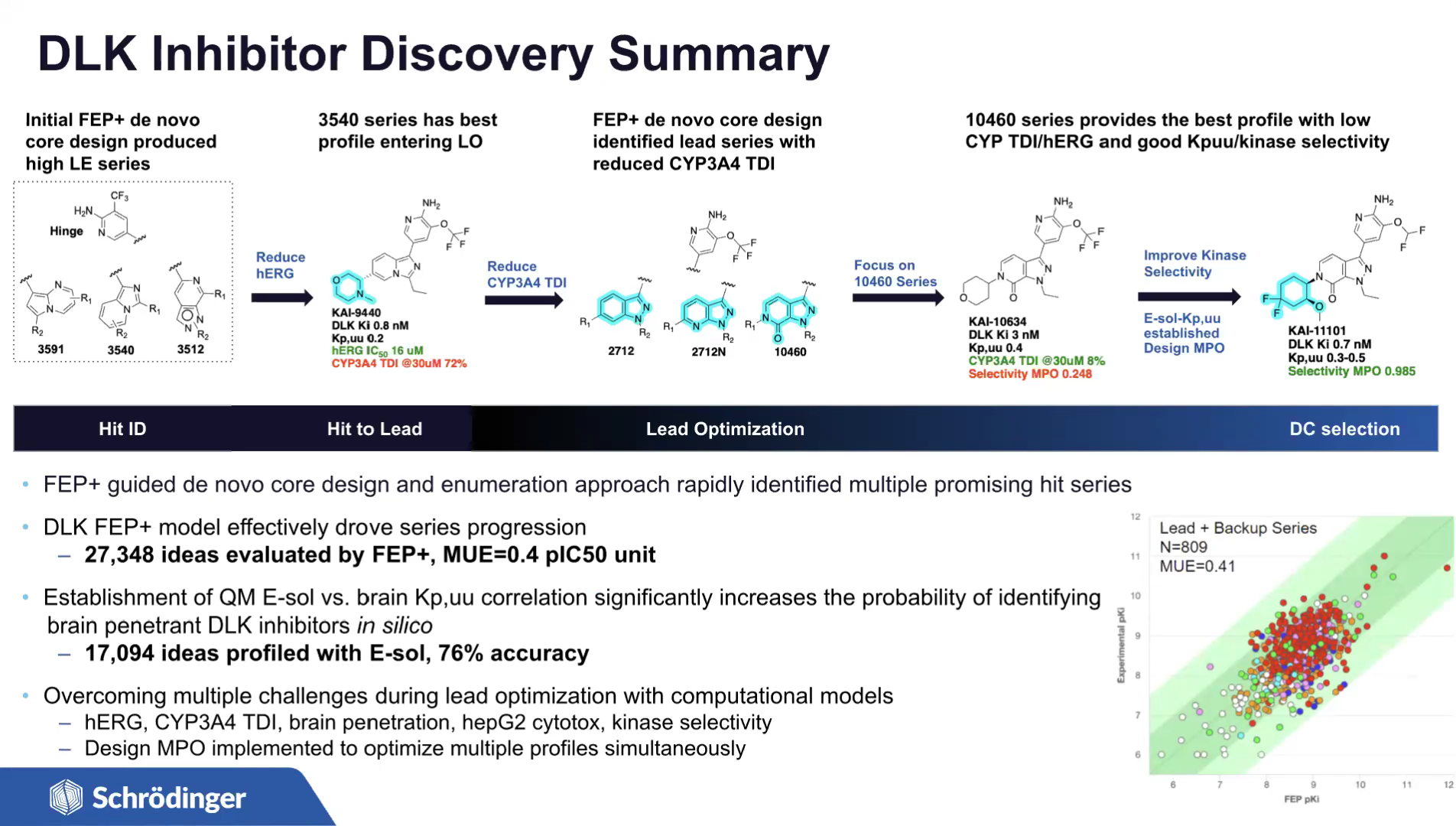
图注:DLK抑制剂的开发过程总结
参考文献
Lagiakos, H. Rachel, et al. "In silico enabled discovery of KAI-11101, a preclinical DLK Inhibitor for the treatment of neurodegenerative disease and neuronal injury." Journal of medicinal chemistry 68.3 (2024): 2720-2741.



