在上篇中,研究人员借助计算模拟工具,依据预测的效价、合成可行性,以及母核在多个不同方向上开展多样化构效关系(SAR)研究的适配性,优选出3个母核。
接下来便是先导化合物优化阶段(Lead Optimization),研究人员对这3个化合物系列开展了平行探索,经过多轮结构设计、FEP+评估、合成、生物学测试及药物吸收、分布、代谢、排泄/药代动力学(ADME/PK)分析后,综合强效DLK抑制活性与良好的口服药代动力学特性,确定咪唑并吡啶系列为最具潜力的化合物系列。
研究人员解析了hDLK与化合物12(KAI-3540)的共晶结构(如下图),证实了该化合物在激酶结构域的结合模式,明确指出了后续优化的方向:通过对咪唑环C3位进行取代修饰,有望实现与P环(P-loop)的相互作用,而C6位是朝向溶剂的修饰位点,可作为理化性质调控的切入点(例如引入增溶基团)。
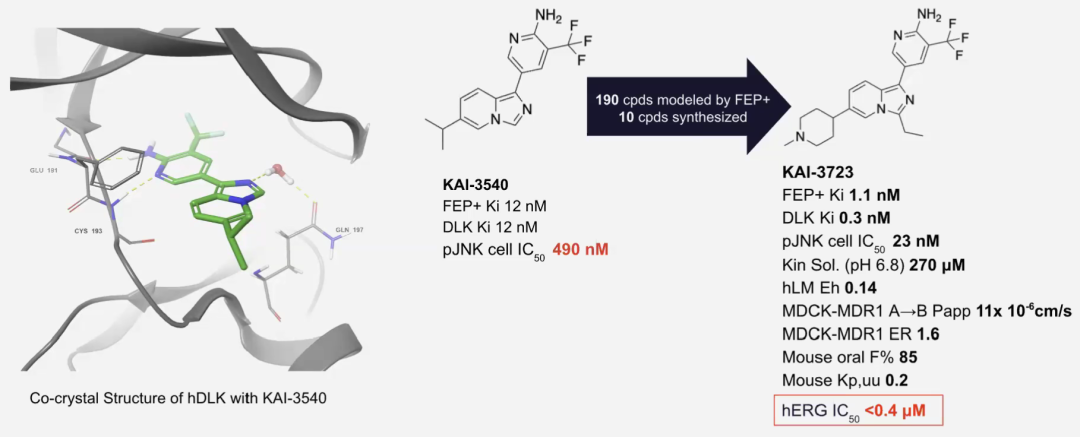
图注:快速推进咪唑并吡啶先导化合物系列(3540系列)
在C6位取代修饰过程中,研究团队将化合物库枚举与合理设计相结合。由于FEP+技术能捕捉配体与蛋白质活性位点残基间的构效关系,可指导研发方向聚焦于有利的构效关系,因此仅选取FEP+预测DLK抑制活性优异的优势化合物进行合成。 含有N-甲基哌啶-4-基溶剂暴露基团的化合物17(KAI-3723)表现出优异的活性与溶解度,被用作C3位修饰探索的核心骨架。在C3位取代修饰过程中,引入小型烷基取代基或极性更强的四氢呋喃(THF)杂环后,化合物在生化实验与细胞实验中的活性均提升近5倍。并且,FEP预测的Ki值与实验测得的Ki值仍保持良好一致性。上述结果表明,C6位与C3位均具备良好的修饰多样性,未来可作为化合物理化性质调控的关键位点。 为降低化合物对hERG的抑制作用,研究团队尝试了多种策略:降低LogD、增加分子三维结构复杂度、调节碱性,或综合使用这三种策略。然而,引入极性基团或增加分子三维结构复杂度并未显著降低hERG抑制作用。在所有化合物系列中,均未观察到LogD与hERG IC50之间存在相关性。 图注:采用Jaguar pKa计算工具减少hERG抑制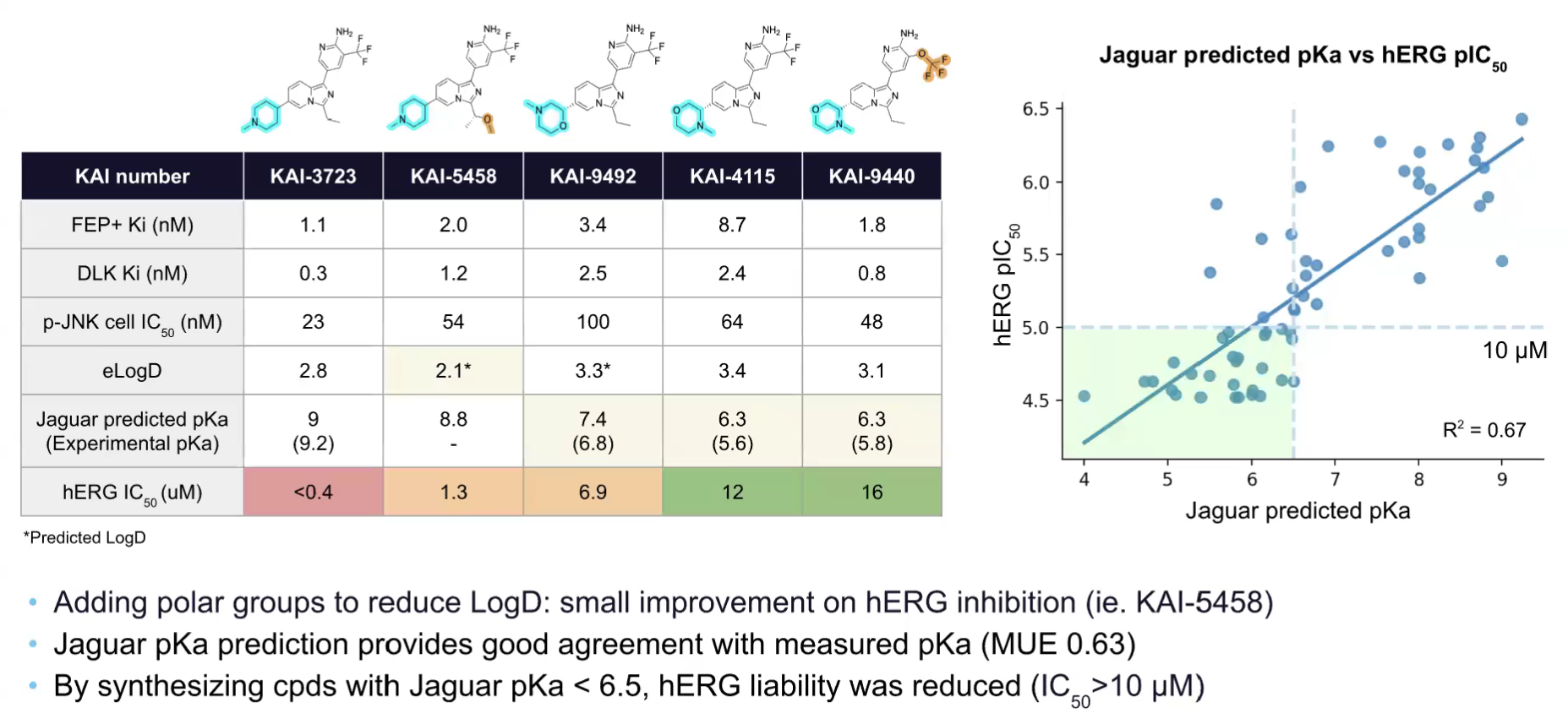
随后,研究团队尝试调节碱性氨基官能团的解离常数(pKa),并通过Jaguar pKa计算工具筛选出预测碱性会降低的化合物优先进行合成。Jaguar预测的pKa值与实验测定值具有强相关性。随着分子pKa值的调节,hERG抑制作用也呈现出减弱的趋势。随后,通过调节分子的碱性可进一步减轻hERG抑制,且Jaguar pKa能够实现对pKa值的准确预测。 依据ADME等性质,咪唑并吡啶系列多数化合物为BCS I类,具有高水溶性、高通透性,中枢神经系统多参数优化(CNS MPO)评分优异,提示其具有较高的血脑屏障穿透概率。其中,化合物26(KAI-9440)表现突出,DLK Ki 0.8nM,p-JNK细胞IC50 48nM,hERG IC50 16μM,小鼠口服生物利用度100%,Kp,uu(脑内游离药物与血浆游离药物的比值)0.2,且在背根神经节神经元模型中轴突保护EC50 305nM,验证了靶点结合与表型保护作用。 图注:减少3540系列的CYP3A4 TDI作用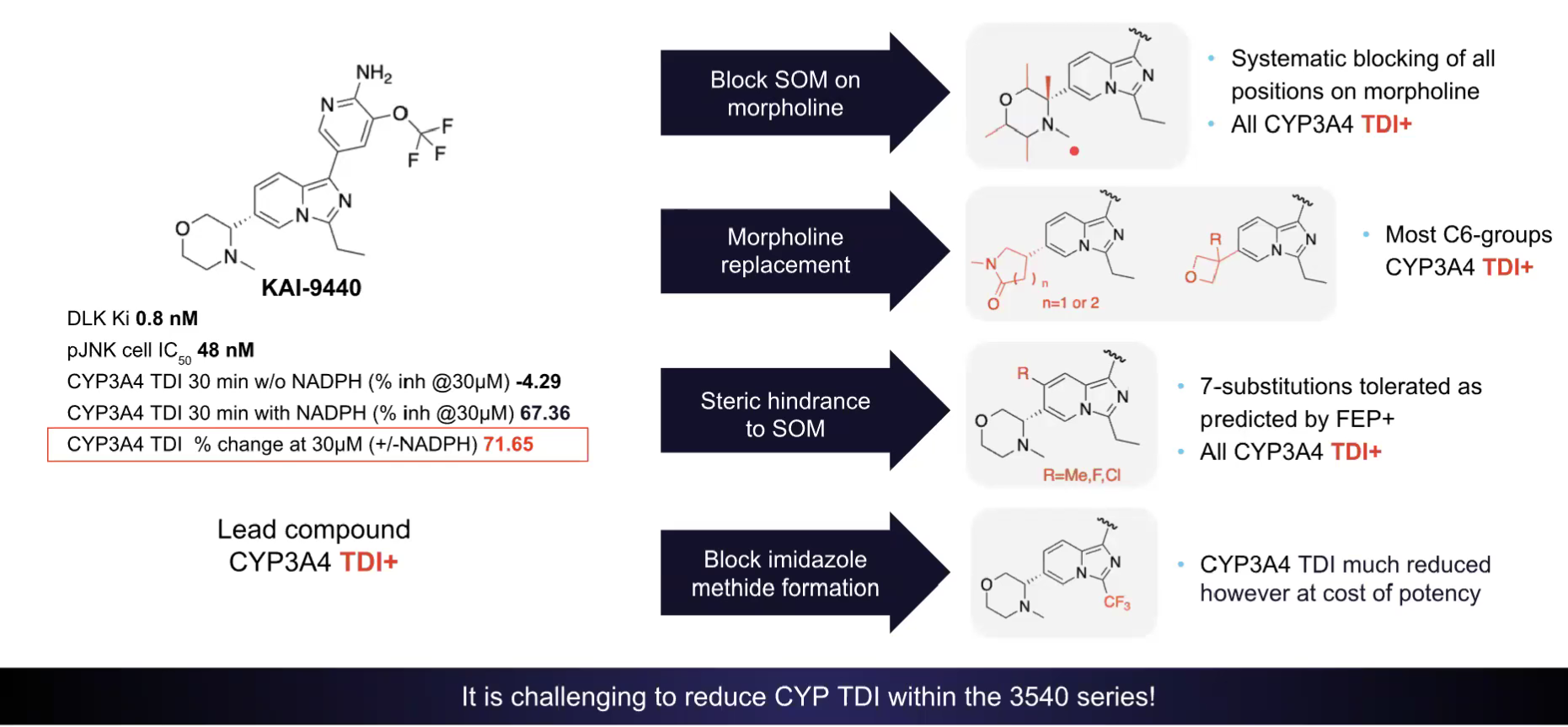
然而,化合物26存在CYP3A时间依赖性抑制,临床可能会有药物-药物相互作用(DDI)风险。虽将咪唑环乙基换为CF₃(化合物37)可显著降低该风险,但化合物37细胞活性骤降。总之,在该系列化合物的优化中,平衡CYP3A TDI、活性及ADME特性仍是核心挑战。 至此,吡唑并吡啶系列的探索似乎并不能产生最优的化合物。那么更加完美的KAI-11101(化合物59)是如何优化出来的呢?请关注下一篇。
参考文献: Lagiakos, H. Rachel, et al. "In silico enabled discovery of KAI-11101, a preclinical DLK Inhibitor for the treatment of neurodegenerative disease and neuronal injury." Journal of medicinal chemistry 68.3 (2024): 2720-2741.



