特此感谢天津中医药大学药理学吕明博士提供本文
背景
类风湿性关节炎(RA)和2型糖尿病(T2D)都为长期、复杂的系统性疾病,能够增加心血管疾病的发病率和死亡率。RA是一种以关节病变为主的慢性全身自身免疫性疾病,发病过程中常伴有免疫系统的激活、炎症反应等参与。T2D是一种由胰岛素依赖性组织对胰岛素生物学效应减弱(胰岛素抵抗)以及胰岛β细胞缺陷而形成的以空腹和餐后高血糖为主要特征的代谢异常综合征。传统上说,T2D不被认为是一种自身免疫性疾病,但越来越多的报道揭示其与包括低级炎症相关的免疫反应机制密切相关。研究表明,当患者患有RA时,其患T2DM的风险明显增加。免疫反应相关的机制是否为此两种疾病发病的共同原因仍需进一步的讨论和论证。综上,我们提出假说:免疫反应为RA和T2D的共同发病机制。
随着二代测序技术的发展,mRNAs水平的高通量测序技术得到了广泛的应用。IPA在组学分析中的作用尤为方便。结合IPA 独特的“Comparison Analysis”模块可将两组或多组组学数据对比分析的功能,能够很好的阐释和分析疾病之间的共同生物过程(功能),基因通路,代谢通路,上游调控因子,关键基因等。IPA软件“Core Analysis”下的“upstream regulators”预测功能,能够帮助诸多研究者从组学数据中找到较为关注的上游调控分子做进一步的信号通路机制研究,并为新药开发提供新的视角。
方法
1.收集临床病例
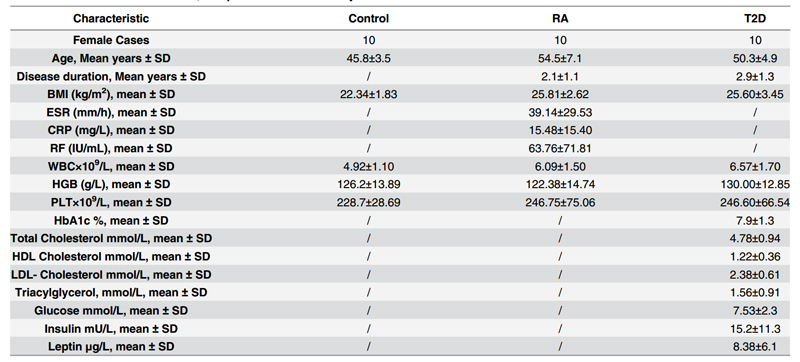
严格按照临床相关标准分别搜集健康人和RA、T2D病人各10人(共30人),采集血液,梯度离心分离外周血单核细胞(PBMCs),-80℃保存备用,如表 1。
表 1 正常组和RA、T2D患者组病例采集信息
2.获得差异表达基因
①从得到的PBMCs中利用试剂盒提取分离总RNA,将RNA样品的吸光度A260/A280值控制在 1.8–2.2,RNA完整性系数(RIN值)>7.0。②分离mRNA,反转录合成双链cDNA,建立Illumina文库,Solexa方法进行测序。③分别将“RA患者”的基因和“T2D患者“的基因与正常组基因比较,设置筛选区间(Fold Change>1.5,p-value <0.01),得到的差异表达基因(DEGs),在后续介绍中分别用“RA”和“T2D”表示。
3.IPA分析
①将RA和T2D组的基因通过IPA的“Upload”选项导入。②通过“Core analysis”模块分别对RA和T2D组的基因进行分析;与此同时,通过“Comparison”模块对RA和T2D组的基因进行对比分析。③通过IPA的聚类功能,进一步分析RA和T2D组基因所调控的功能、通路、上游调控因子(Upstream Regulator)。
4.实验验证
通过IPA分析得到的22个关键候选基因,通过Q-PCR方法在搜集的临床血液样本PBMCs中进行验证。
结果
1.根据得到的测序结果,与正常组相比,得到212个RA相关的差异基因和114个T2D相关的差异基因。RA差异基因中有157个基因上调,23个基因下调;T2D差异基因中有48个基因上调,34个基因下调;红色代表上调基,绿色代表下调基因,如图1。
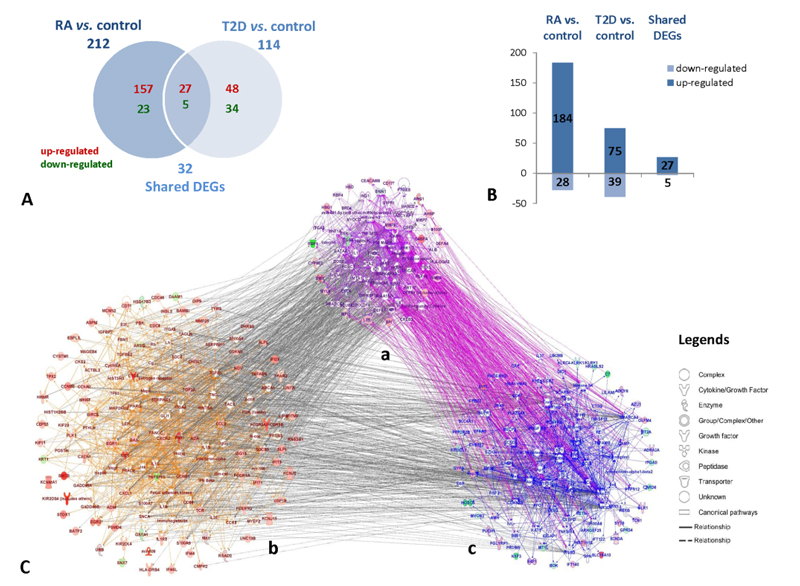
图 1 RA和T2D患者组与正常组基因差异数量
2.基于差异基因,通过IPA的对比分析功能对RA和T2D的差异基因进行深入分析。得到RA和T2D共同的P值分数(P值用于衡量相关度,P值越低,表示相关度越高)最低的10个Top 10信号通路:completement system, agranulocyte adhesion and diapedesis, granulocyte adhesion and diapedesis, IL-8 signaling, differential regulation of cytokine production in macrophages and T helper cells by IL-17A and IL-17F, Natural killer cell signaling, differential regulation of cytokine production in intestinal epithelial cells by IL-17A and IL-17F, acute phase response signaling, crosstalk between dendritic cells and natural killer cells, and OX40 signaling pathways,如图 2A。细节展示,如图 3。在Top 10信号通路中涉及调控的19个关键差异基因: CYP4F3↑, DEFA4↑, DEFA1↑, MMP8↑, MMP9↑, MT2A↓, ITGB4↓, RBP1↓, SNAI1↓, ARG1↑, MPO↑, LTF↑, C4BPA↑, MYL4↑, HLA-DQA2↑, CA1↑, SELENBP1↑, BPI↑, CD177↑, CA4↑, BMX↑,如表 2。得到RA和T2D共同的P值分数最低的10个Top 10生物功能: systemic autoimmune, syndrome, rheumatic disease, system lupus erythematosus, binding of cells, rheumatic arthritis, arthritis, chronic inflammatory disorder, binding of blood cells, cell death and apoptosis,如图 2B。这些功能大部分与免疫功能紊乱相关。在Top 10生物功能中涉及调控19个关键差异基因:ARG1↑, BPI↑, CA1↑, CYP4F3↑, DEFA4↑, DEFA1↑, HLA-DQA2↑, LTF↑, MMP8↑, MMP9↑, MPO↑, SELENBP1↑, CD177↑, ITGB4↓, SNAI1↓, MT2A↑, BMX↑, CA4↑,这些基因多数可归类于免疫反应,如表 2。由此可见,免疫反应可能为RA和T2D的共同潜在机制。
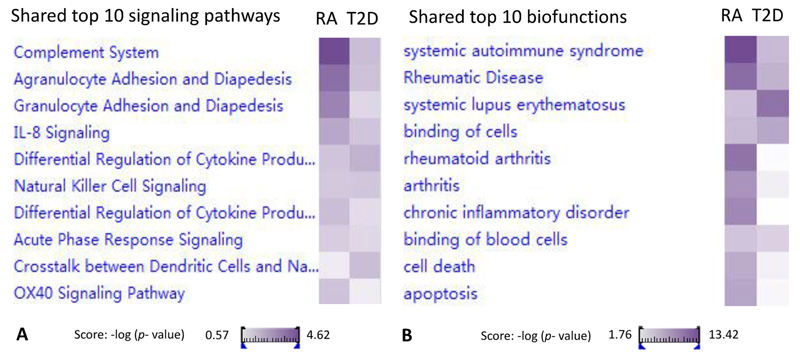
图 2 RA和T2D相关的Top 10信号通路和功能热图
表 2 RA和T2D相关的Top 10信号通路和功能相关调控基因(黑色斜体代表两种疾病差异基因中共同基因)
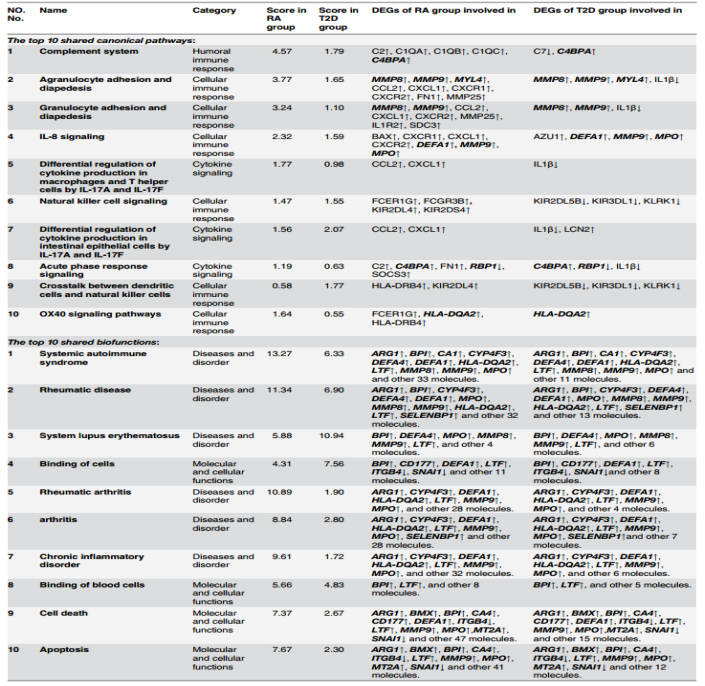
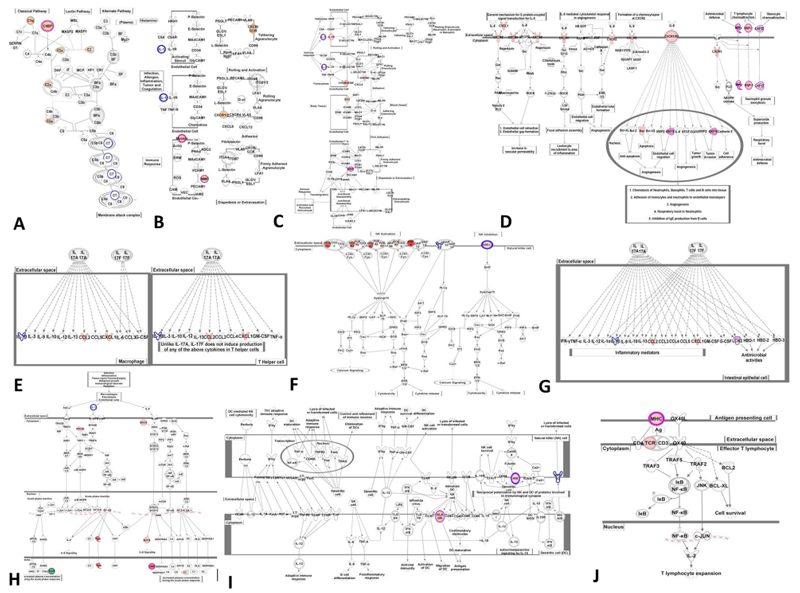
图 3 RA和T2D相关的Top 10具体信号通路
3.基于RA和T2D的差异基因,通过IPA对其的上游调控因子进行预测。根据IPA的P值,选出较为关心的5个上游调控分子:TGM2, NF-кB, p38 MAPK, TNF, CEBPA,这5个分子在RA和T2D中均为基因表达上调,如表3。5个上游调控分子所调控的下游基因及5个上游调控分子在RA和T2D中分别调控的下游基因,如图 4。
表 3 上游调控因子所涉及的下游调控基因及基因相关功能
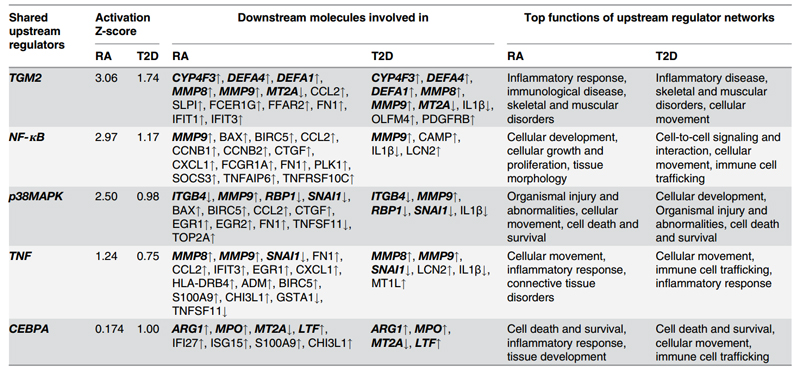
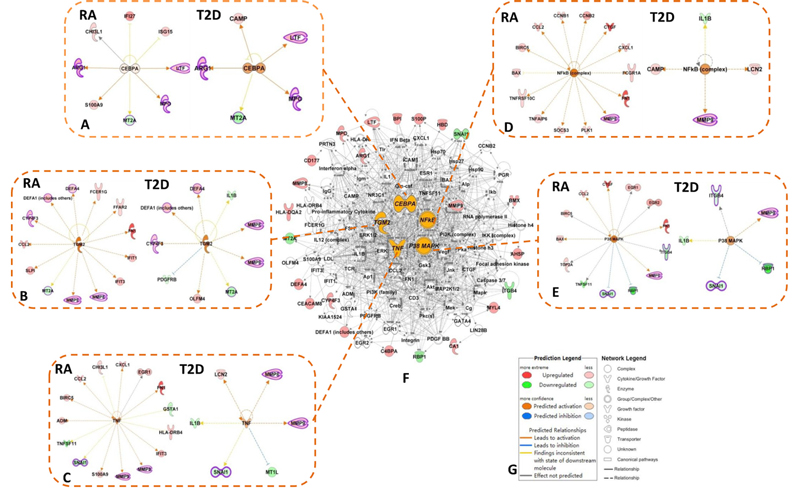
图 4差异基因的上游调控因子及其在RA和T2D中的作用关系
4.整合Top 10信号通路和Top 10功能相关的关键基因共22个:DEFA1↑, RBP1↓, C4BPA↑, MYL4↑, HLA-DQA2↑, CA1↑, ARG1↑, BPI↑, CYP4F3↑, DEFA4↑, HLA-DQA2↑, LTF↑, MMP8↑, MMP9↑, MPO↑, SELENBP1↑, CD177↑, ITGB4↓, SNAI1↓, MT2A↑, BMX↑, CA4↑。通过Q-PCR对RA和T2D的PBMCs中关键差异基因进行验证,其中12个基因与正常组相比,具有显著性差异表达。其中基因表达显著上调的8个基因为C4BPA, ARG1, MMP9, DEFA1, CYP4F3, LTF, MPO, DEFA4,MMP8,p-value < 0.01;基因表达显著下调的3个基因为RBP1, SNAI1,MT2A,p-value < 0.01,如图 5。 进一步对RA组和T2D组与正常组相比的差异基因与免疫相关的基因通路进行整合,如图 6。
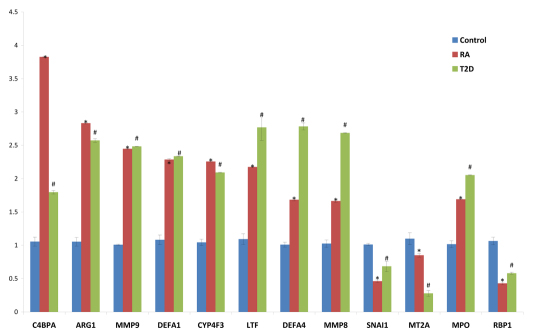
图 5 RA和T2D与正常组对比的差异基因Q-PCR验证
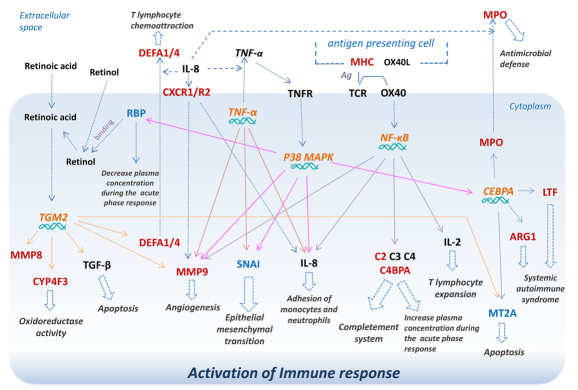
图 6 RA和T2D与免疫相关的基因通路汇总
结论
1.免疫反应为RA和T2D的共同机制,分析得到的Top 10信号通路、Top 10功能、关键的5个上游调控因子及免疫相关的通路整合,为后续临床治疗RA和T2D提供新的治疗策略,也为针对此两种疾病的新药研发提供较好的参考依据。
2.IPA的对比分析功能能够高效的从分子机制角度阐述两种或多种疾病之前存在的异同点,无论是针对阐释西医治疗多种疾病及其并发症,还是中医对于疾病的整体观理论,都能得到较好的应用。
3.实验验证出的结果和IPA分析出的差异基因结果趋势基本一致。再一次证明IPA分析的可靠性和准确性。
4.以此案例为参考,研究者可深入进行其它两种或多种疾病的对比研究,也可举一反三到不同药物对比作用机制研究中,为临床、基础、药物研究等提供很好地思路和借鉴。
原文:Niu X, Lu C, Xiao C, et al. The Crosstalk of Pathways Involved in Immune Response Maybe the Shared Molecular Basis of Rheumatoid Arthritis and Type 2 Diabetes. PloS one, 2015;10(8):e0134990.



