背景介绍
阿尔茨海默病(AD)是以记忆力减退和认知功能损伤为特征的神经退行性老年痴呆症,其广泛性、长久的治疗周期、高额的医疗花费和无法从病理上治愈等特点,已经成为主要的公共健康问题。而b淀粉蛋白的沉积是AD病理发展的起始因素。乙酰胆碱酯酶(AChE)是b淀粉蛋白的分子伴侣,其外周阴离子位点(PAS)能诱导b淀粉蛋白的聚集,进而形成乙酰胆碱酯酶-b淀粉蛋白稳定的聚合物,最终导致淀粉蛋白的沉积,引发老年痴呆。
实验过程
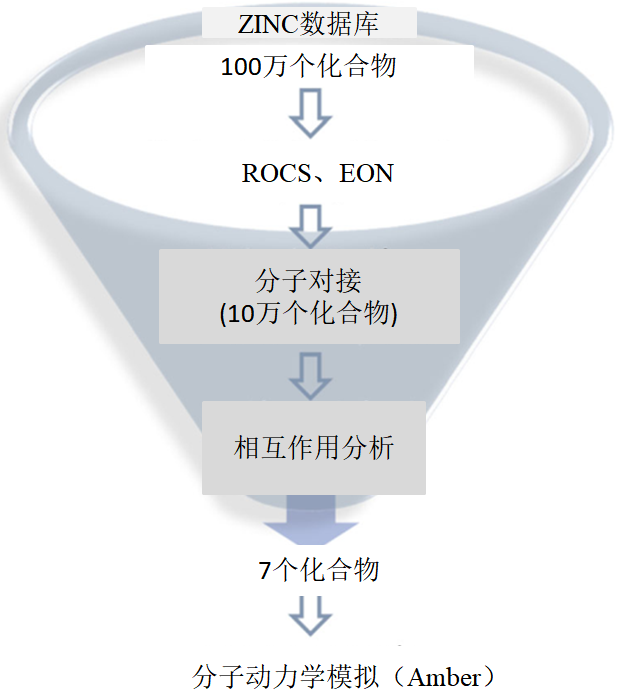
图1 实验过程
研究选择5个已知的hAChE抑制剂作为提问结构,使用形状相似性(ROCS)方法进行筛选效率的验证,结果发现化合物donepezil可以命中较多活性化合物,并且它还有两个结合位点(活性中心CAS和外周位点PAS),是有效的AD抑制剂。因此,选择donepezil作为提问结构进行下一步的虚拟筛选。首先基于提问结构的静电(EON)性质进行筛选,然后进行对接筛选,最后进行动力学模拟研究,发现候选抑制剂N01。
实验结果
1. 筛选结果
选择已知抑制剂(图2)作为提问结构,使用ROCS进行筛选效率的验证,结果发现抑制剂donepezil命中活性化合物的概率较高,可以作为下一步虚拟筛选的提问结构进行筛选研究。
选择蛋白质晶体结构(4EY7)中的donepezil构象作为提问结构,进行静电相似性虚拟筛选,命中静电相似性值ET在0.60-0.94之间的10万个化合物。然后进行对接筛选,命中对接打分较高,并且与对接位点处氨基酸相互作用较强的7个化合物(图3)。命中化合物N01和活性口袋周围关键氨基酸形成氢键、p-p堆积、阳离子-p相互作用。氢键相互作用有:N01和Phe295的O原子形成2.68 Å的氢键作用,和His447的咪唑环的N原子形成1.92 Å的氢键作用,和Tyr124的哌嗪环的N原子形成2.15 Å的氢键作用。p-p堆积相互作用有:Trp86的芳香环和N01的咪唑环,Trp286的芳香环和N01的苯环。命中的7个化合物都可以和氨基酸Ser293、Phe295、His447、Tyr 124、Tyr133形成氢键相互作用,和氨基酸Tyr337、His447、Trp86、Tyr341、Phe338、Trp286和Tyr124形成p-p堆积、阳离子-p相互作用(图4)。关键氨基酸Phe295、Tyr337、Tyr124、Trp286、Trp86和Tyr341在配体与蛋白的相互作用中扮演着重要的角色。对接结果表明,命中的7个化合物可以作为hAChE候选抑制剂物进行下一步研究。
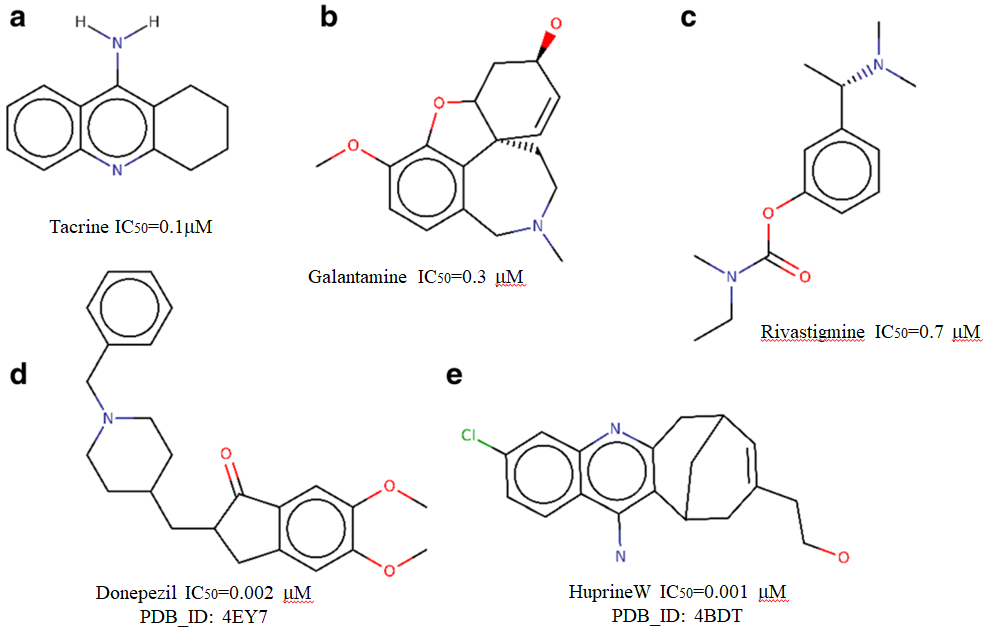
图 2 5个已知的hAChE抑制剂的结构
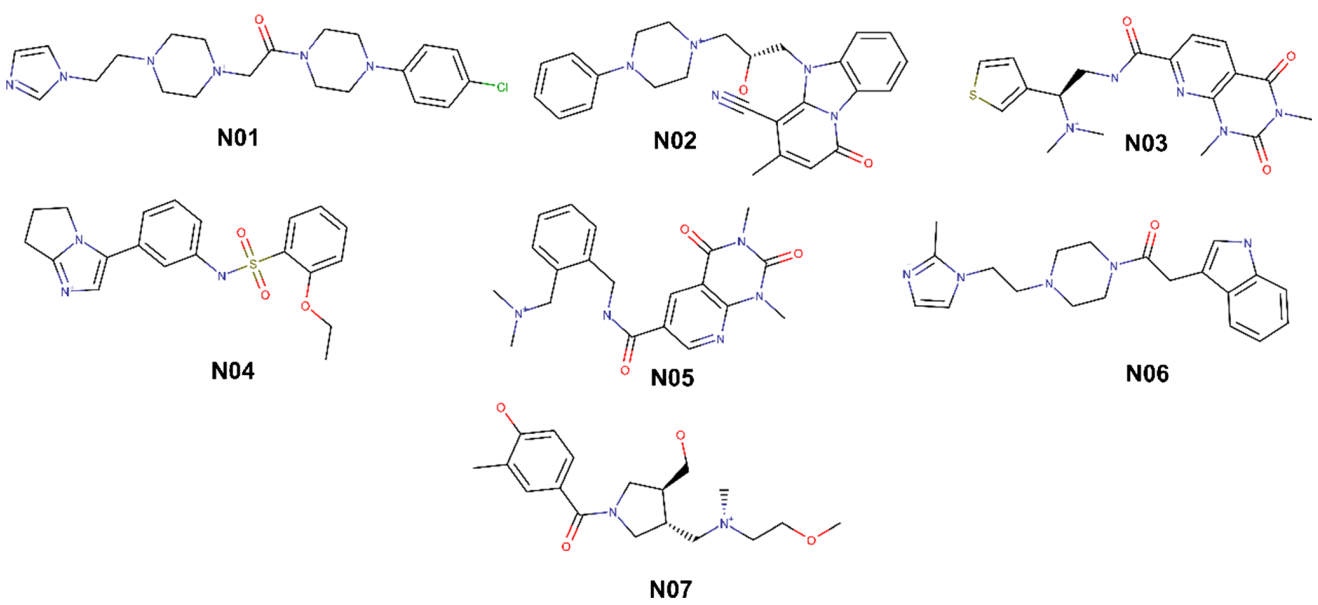
图3 命中的7个化合物结构
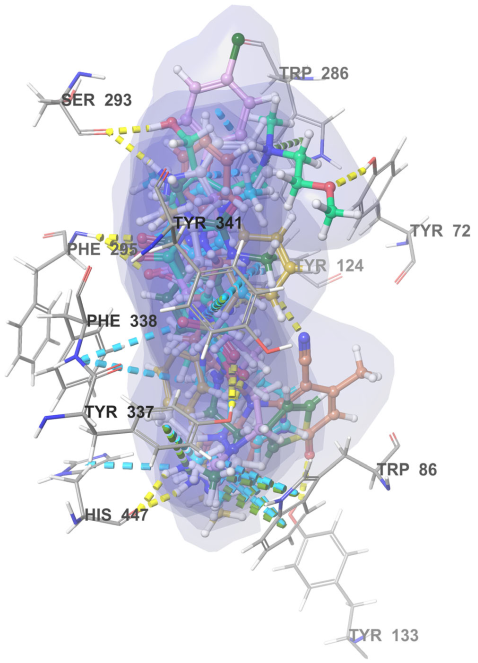
图4 命中化合物与hAChE(4M0E)的对接结果
2. 动力学模拟结果
为了进一步研究这7个命中化合物,我们进行了100 ns的动力学模拟。动力学结果发现,化合物N01在100ns的动力学模拟过程中构象变化不大,在活性口袋中很稳定(图5)。7个复合物在动力学模拟过程中主链C的均方根偏差(RMSD)在55ns以后都保持稳定(图6)。在整个动力学模拟过程中RMSD值未超过6 Å。通过动力学模拟优化了hAChE和化合物之间的相互作用,形成了稳定的结合构象。动力学模拟结果同样表明,通过静电相似性筛选、对接筛选命中的7个化合物可以作为hAChE候选抑制剂进行后期研究。
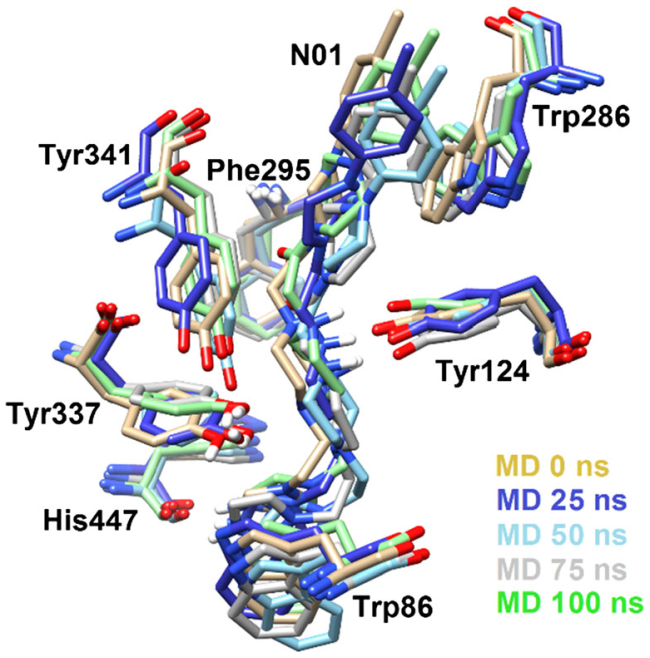
图5 化合物N01和活性口袋周围关键氨基酸在动力学模拟过程中的构象变化
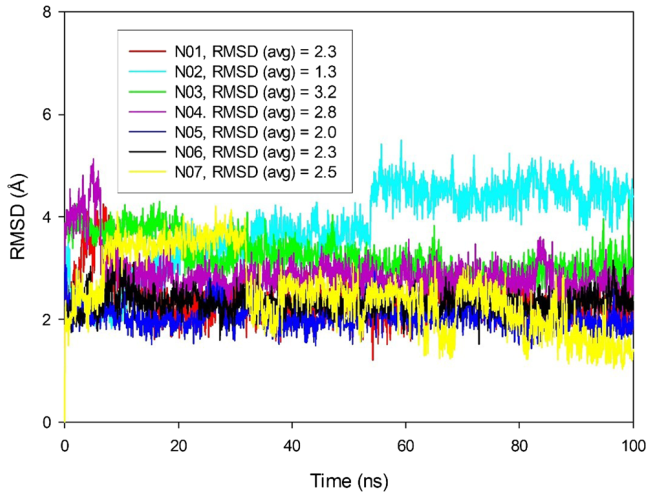
图6 动力学模拟过程中的均方根偏差(RMSD)
结论
研究通过静电相似性筛选和分子对接成功地发现了7个新型hAChE抑制剂。分子对接和动力学模拟主要用来研究命中化合物和hAChE之间的相互作用模式。研究发现活性位点处的氨基酸Phe295、Tyr337、Tyr124、Trp286、Trp86和Tyr341在发现双结合位点的抑制剂中非常重要。研究结果表明,静电相似性(EON)筛选和分子对接可以帮助我们快速地发现新型hAChE抑制剂。此外,化合物的芳香环和氨基酸Trp83、Tyr334之间的疏水相互作用是新型hAChE抑制剂发挥生物活性的重要特征。这些化合物可以作为治疗阿尔茨海默病的候选化合物。
使用模块: ROCS、EON(点击查看模块详细介绍)
参考文献
Borges N M, Sartori G R, Ribeiro J F R, et al. Similarity search combined with docking and molecular dynamics for novel hAChE inhibitor scaffolds[J]. Journal of Molecular Modeling, 2018, 24(1):41.



