前言
生物膜广泛存在于一些病原菌导致的慢性和急性感染中,通常对抗生素治疗有较强的耐药性。细菌二鸟苷酸环化酶(DGCs)以两个鸟苷-5’-三磷酸(GTP)为原料合成环二鸟苷酸(c-di-GMP)。c-di-GMP是细菌体内普遍存在的第二信使分子,参与调节细菌的多种生理功能,包括细菌通讯、细胞分化、生物被膜形成、细胞形态变化等。c-di-GMP在细菌的生物被膜形成和致病因子产生方面起到至关重要的调节作用。
c-di-GMP在细菌胞内的合成和降解,分别受到含有GGDEF(Gly-Gly-Asp-Glu-Phe)结构域的二鸟苷酸环化酶(DGC)和含有EAL(Glu-Ala-Leu)结构域的磷酸二酯酶(PDE)催化。细菌内这两个结构域常与具有信号感应的结构域偶联,从而传递胞外信号包括磷酸化、光照、离子结合、抗生素压力等外界环境变化,进而产生相应的细胞生物学行为来适应外界环境。DGCs含有GGDEF和EAL结构域,是一个双功能蛋白酶,可以同时合成和降解c-di-GMP,如果两个结构域分开则都失去活性。
研究发现几个重要的致病菌:铜绿假单胞菌、沙门氏菌、霍乱弧菌等都含有大量的c-di-GMP代谢蛋白,因此c-di-GMP可以作为治疗细菌感染的重要靶标。本研究基于虚拟筛选的方法筛选DrugBank数据库中FDA批准的药物,发现潜在的c-di-GMP抑制剂,用于治疗病菌感染引起的慢性疾病。
实验过程
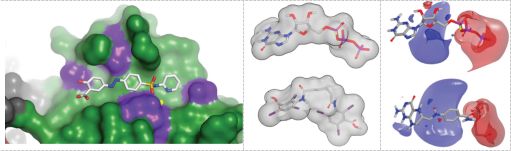
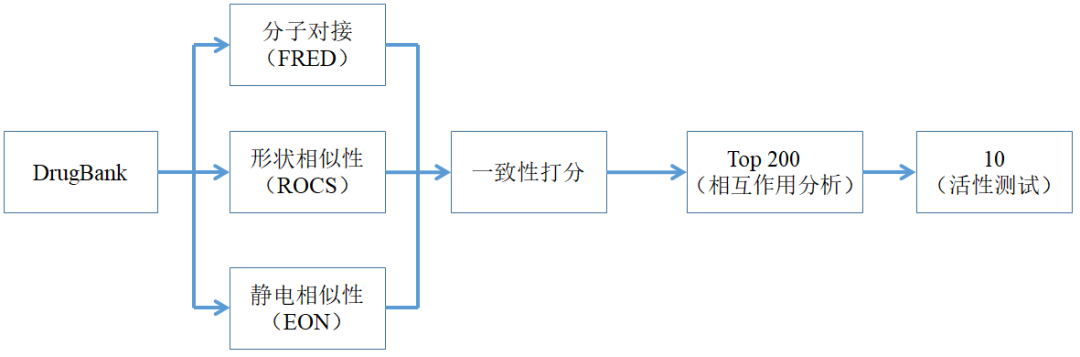
图1 实验过程
研究选择DrugBank数据库中的化合物进行虚拟筛选。首先使用OMEGA对数据库中的化合物进行构象枚举,排除能量低于25.0 kcal.mol-1的构象。接着使用QUACPAC进行pKa计算和互变异构枚举。选择已知抑制剂GTP-a-S(PDB_ID:2V0N)作为提问结构进行形状相似性(ROCS)筛选、静电相似性(EON)筛选、对接(FRED)筛选,针对这三种筛选方法得到的ST值、ET值和Total Score值进行排序,选择排名靠前的200个化合物进行相互作用分析。 最后再对命中的10个化合物进行生物活性测定。
实验结果
1. 筛选结果
研究选择的蛋白质晶体是c-di-GMP二聚体结构。该蛋白(PDB_ID:2V0N)是从新月柄杆菌(Caulobacter crescentus)PleD中分离出来的,包含有GGDEF和REC(类似于CheY的磷酸受体)结构域。对接筛选得到的小分子作用于A-site活性位点,该活性区域是由残基D327、F330、F331、K332、N355、D344、E370、K442和R446组成的保守区。保守性较高的残基N355和D344能特异性识别GTP。
使用FRED方法进行对接研究,首先将GTP-a-S重新对接到蛋白中,对接打分为-40 kcal.mol-1。然后我们将预处理好的1500个化合物的DrugBank库进行对接,结果40%的化合物都能对接成功,5.9%的化合物对接打分比-40 kcal.mol-1高。同时,我们使用形状相似性和静电相似性进行了筛选,得到和提问结构GTP-a-S形状相似性(ST值)、静电相似性(ET值)较高的化合物。
联合基于受体(分子对接)筛选和基于配体(形状、静电)筛选的结果,对命中的化合物进行综合评价,然后选择200个分值最高的化合物进行相互作用分析,最后选择命中的10个化合物进行生物活性评价。
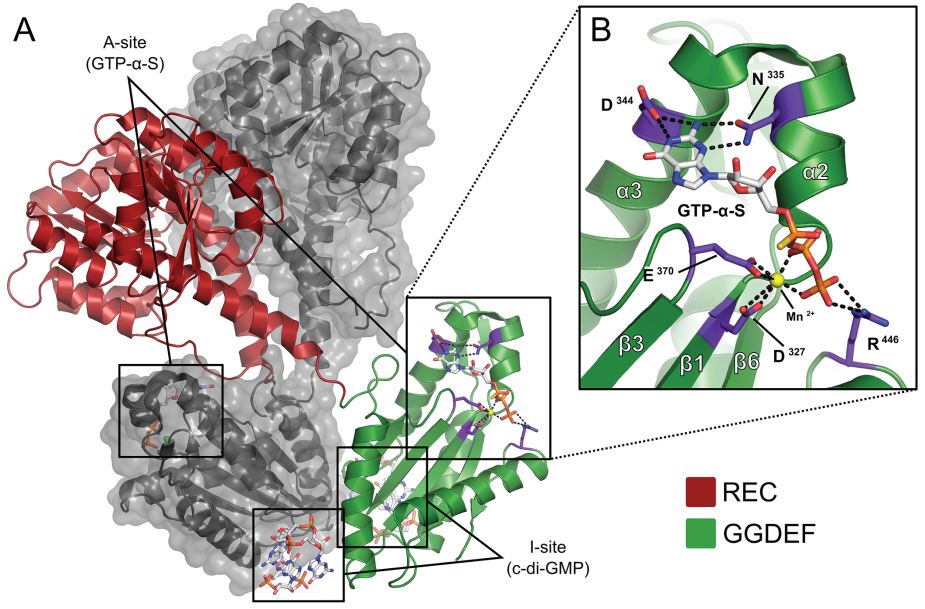
图2 c-di-GMP二聚体(PDB_ID:2V0N)晶体结构
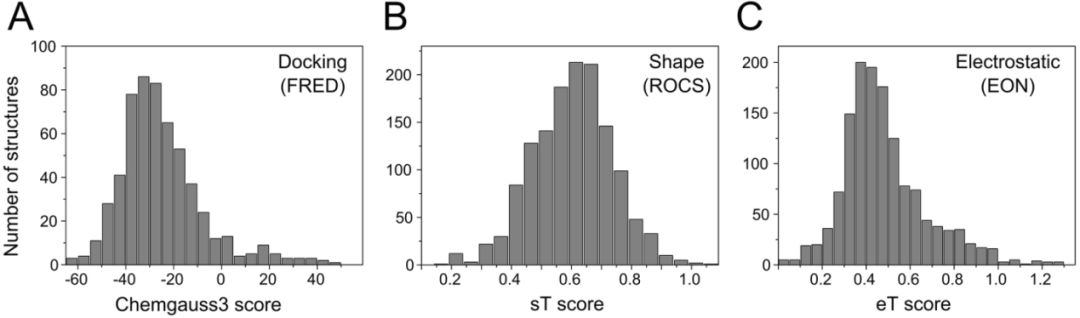
图3 筛选结果:对接筛选(A),形状相似性筛选(B),静电相似性筛选(C)
2. 活性测定结果
研究测定了命中的10个化合物(图4)对铜绿假单胞杆菌的二鸟苷酸环化酶(WspR)和大肠杆菌的二鸟苷酸环化酶(YdeH)的抑制活性。命中化合物sulfasalazine、folic acid、novobiocin对蛋白WspR和YdeH都表现出较好的抑制活性。化合物eprosartan对蛋白WspR的抑制活性较好,但是对蛋白YdeH的抑制活性却较差。抑制活性相差较大的原因可能是eprosartan与蛋白WspR活性位点A-site周围的残基Y212 、S215存在相互作用,而与蛋白YdeH活性位点A-site周围的残基R168 、L171存在相互作用。
研究使用了ESI-MS方法测定命中化合物的解离常数(Kd)。测得的7个化合物的Kd值在37-493 mM范围内。其中使用ESI-MS方法测定的GTP解离常数Kd为7.3 mM,而酶活性测定结果得到的GTP解离常数Kd为5.8 mM,因此可以证明ESI-MS方法的准确性。
研究还发现抑制活性较高的化合物都有苯磺酰胺基团。对接结果也发现苯磺酰胺基团占据DGCs蛋白的三磷酸结合区域(A-site)。有研究发现三磷酸结合区域在蛋白DGC抑制剂acyclovir发挥药效的过程中扮演着重要角色。理论研究结果表明虚拟筛选命中的这些化合物可以作为DGC抑制剂进行深入研究。并且命中化合物sulfasalazine和eprosartan分别是FDA批准的抗炎药和抗高血压药。因此筛选命中的结果有望成为新的DGC候选药物。
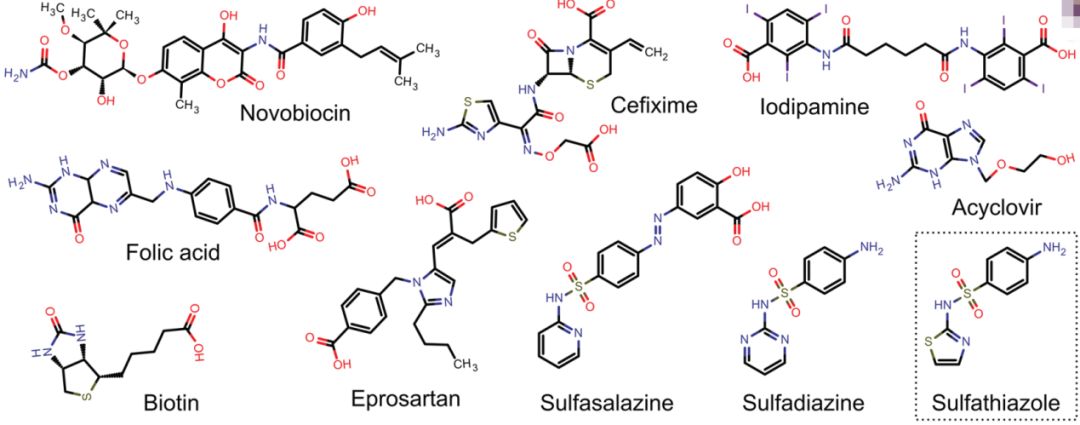
图4 虚拟筛选结果
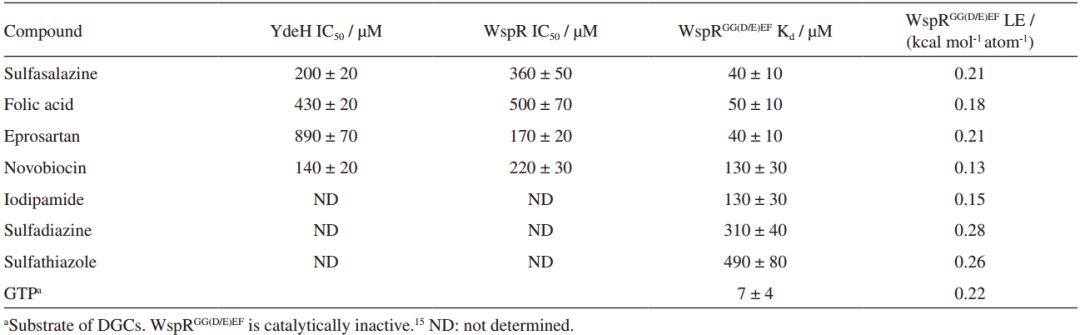
图5 抑制WspR和YdeH的IC50值,以及WspR蛋白的GG(D/E)EF区域的Kd值
结论
研究基于配体和受体方法筛选DrugBank数据库,发现已知的抗炎药sulfasalazine和抗高血压药eprosartan可以作为潜在的DGCs抑制剂。活性测定结果发现命中的化合物对铜绿假单胞杆菌和大肠杆菌的DGC蛋白有较好的抑制活性,IC50值在140-890 mM。研究又使用ESI-MS方法测定了命中化合物的结合亲和力,Kd值在40-490 mM。命中的化合物sulfathiazole、sulfadiazine 和sulfasalazine都有苯磺酰胺基团,对接研究也发现该基团在抑制作用的发挥中具有重要作用。本研究主要是发现了抗炎药sulfasalazine和抗高血压药eprosartan在破坏细菌生物膜方面的活性,并对c-di-GMP信号分子的合成有较好的抑制活性,可以用于抑制DGC蛋白的活性。这一发现丰富了DGC蛋白抑制剂的结构,可以作为先导化合物帮助研究者发现一些结构新颖的DGC蛋白抑制剂。
使用模块:OMEGA、ROCS、EON、FRED
参考文献
1. Helton J. Wiggers, Edson Crusca, Éverton E. D. Silva, et al. Identifcation of Anti-Inflammatory and Anti-Hypertensive Drugs as Inhibitors of Bacterial Diguanylate Cyclases. J. Braz. Chem. Soc., 2018: 29(2), 297-309. doi: 10.21577/0103-5053.20170141



