PIC/S GMP的附录一“无菌药品生产Guide on the manufacture of sterile products”已于今年九月九日公告,正式实施日期和EU的一样,都是在2023年08月25日,而条款8.123有关冻干技术部分,则延后一年,将于2024年08月25日正式生效。因为PIC/S的会员国不限于欧盟,所以有极少数的条款稍微不同。虽然WHO的网页尚未看到相关信息,但此次的附录一的修订,主要是由EMA、PIC/S与WHO的相关专家执行,个人认为有可能会在每年出版的技术报道系列中展出。
为了能较清楚的地了解新版无菌药品生产指南,笔者尝试逐篇解读此指南的内容,因为内容很多,笔者无法确定何时能完成所有的解读,但会尽力为之。也期待有同行能共襄盛举,分担对感兴趣的内容的解读!
内容架构
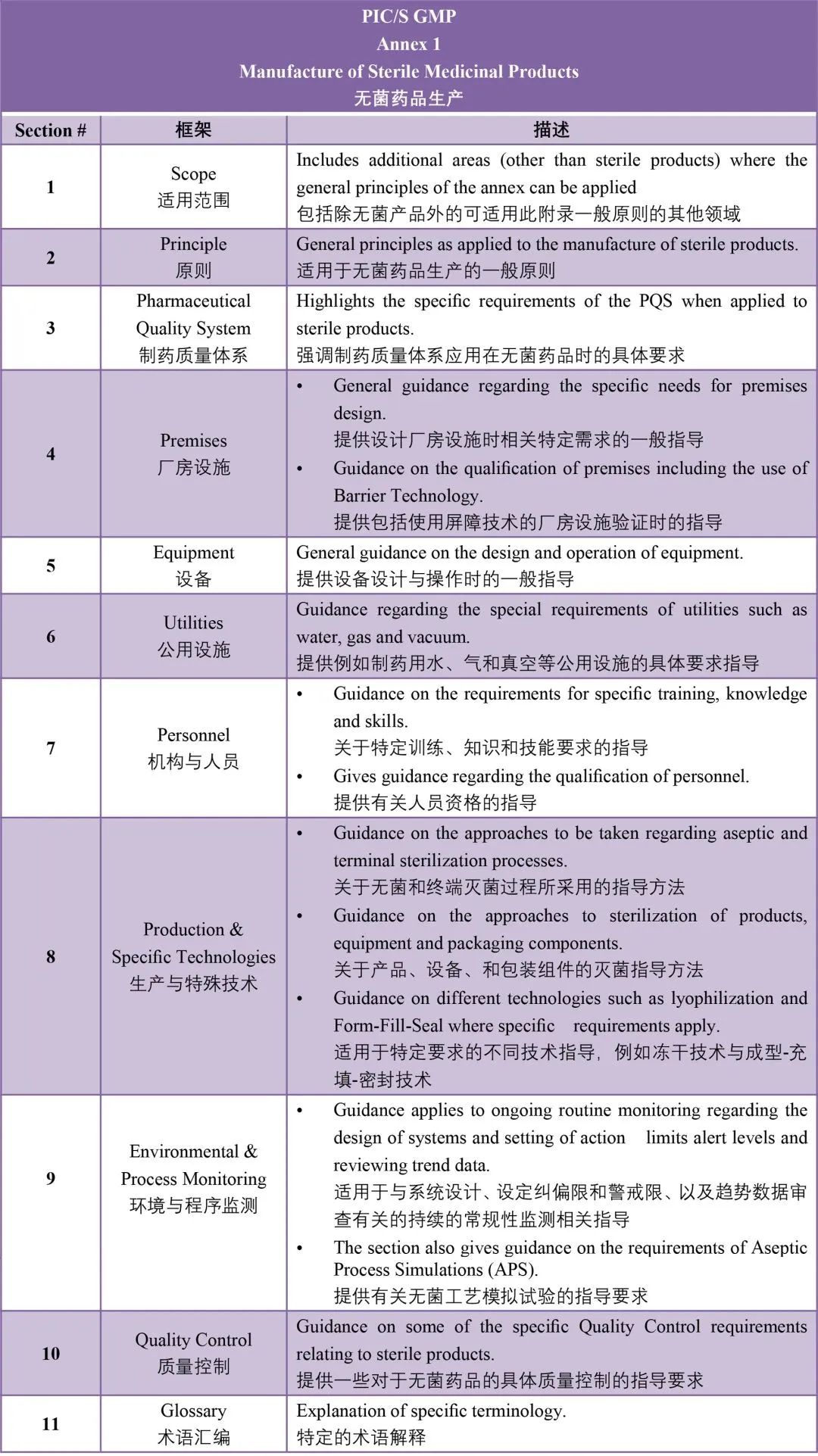
SECTION1 适用范围
此指南涵盖了下列的无菌药品:
工艺中物品来区分:
活性物质(Active Substance )。
赋形剂( Excipients )。
直接接触药品的包装材料( Primary Packaging Materials )。
产品剂型( Finished Dosage Forms )。
以药品包装形式来区分,指南涵盖了下列的包装形式:
单一剂量药品( Single Unit )。
多剂量药品( Multiple Units )。
以工艺技术来区分:
高度自动化系统( Highly Automated Systems )。
手动工艺( Manual Processes )。
生物技术( Biotechnology )。
传统的小分子生产系统( Classical Small Molecule Manufacturing Systems )。
密闭系统( Closed Systems )。
附录提供的指南包括:
无菌药品生产时的设施、设备、系统与程序的设计与管控。
应用质量风险管理( Quality Risk Management; QRM )的原则进行设计与管控。QRM几乎是此指南的重心,也就是说除非特别说明,否则QRM的理念适用于这份指南所有的内容。
确保无菌的最终产品,能避免被微生物、颗粒物质与内毒素/热原的污染。
此附录的有些指导原则,也适用于其他需要管控微生物、颗粒物质与内毒素/热原的非无菌药品的生产,例如:
污染控制策略( Contamination Control Strategy; CCS )。
厂房设施的设计( Design of Premises )。
洁净室的分类( Cleanroom Classification )。
确认与验证( Qualification & Va l i d a t i o n )。
监测( Monitoring )。
人员更衣( Personnel Gowning )。
非无菌药品包括:液剂、霜剂、软膏剂、低负荷菌的生物中间产品。
如果药品生产企业选择将此指南应用于非无菌药品,生产企业应明确记录已适用的原则,并承诺将证明遵守这些原则。
导读
因欧盟EMA、PIC/S与WHO的GMP适用于人用药品,以及兽药( Veterinary Medicinal Products ),所以此新的附录中的指南,也适用于兽药。不过,国内的兽药主管机关为中国兽医药品监察所,兽药生产是否要依循此指南,应由中国兽医药品监察所决定,但是,如果企业声明其厂内GMP符合WHO的要求,个人认为仍应遵循此新的无菌药品生产指南要求。
这次修订的附录一,其内容比新版GMP原文(PE009-16;2022)的内容还要多。GMP原文共有57页,其中包括一页封面与两页的目录;刚出炉的附录一共58页,包括封面与内容大纲各一页。
现有厂房,建议尽早依据此新的附录指南,根据质量风险管理,进行厂房设施、设备、工艺的质量风险分析,以评估是否需要更改硬件?对于设备、系统的验证,液建议再审查原有的报告,以确认能符合新指南的要求。
无菌药品可包括:

无菌制剂(因含有医疗器械,所以用“制剂”)的基本质量要求(仅供参考)
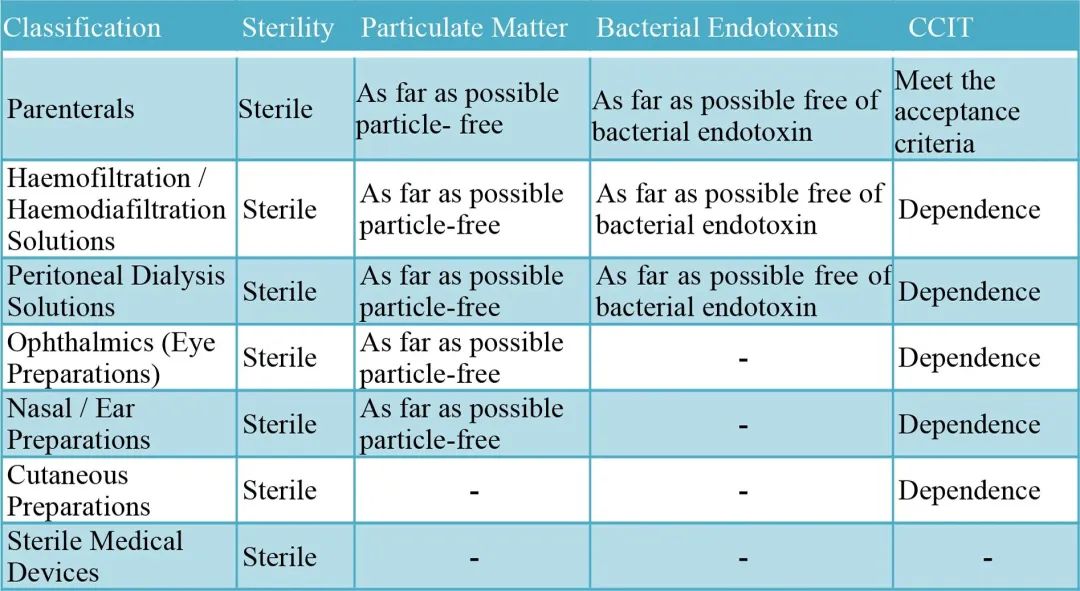
USP 对于针剂药品的质量要求:
Universal Tests
- Identification
- Assay (Content)
- Impurities (Impurities and Foreign Substances)
- Foreign and Particulate Matter
- Sterility
- Bacterial Endotoxins
- Container Content
- Packaging Systems
- Container-Closure Integrity
- Labeling
Specific Teste
- Uniformity of Dosage Units
- Vehicles and Added Substances
- Antimicrobial Preservatives
- Water Content
- Aluminum Content
- Completeness and Clarity of Solution



