前言:
本文对2×2×2(2制剂×2贯序×周期)平均生物等效性的计算方法,以及使用WinNonlin计算得到的结果中大家比较关心的参数,和参数所在的位置进行说明,有疏忽指出还望指出!
生物等效性试验分类:
说起生物等效性试验,我们脑海中就会闪现出典型的2×2×2交叉设计平均生物等效性试验(下文简称为2×2生物等效性试验),他在生物等效性试验的分类中属于比较药代动力学的研究的非重复交叉设计的平均生物等效性的一种典型试验设计。
今天我们就来聊一聊2×2生物等效性试验。
|
统计学模型:
众所周知,在分析2×2生物等效性试验的数据时,我们需要按照监管机构的要求来进行分析,目前美国FDA使用如下统计学模型:
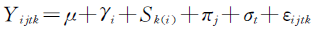
其中k代表个体,j是时段数,i是排序数;Yijtk为第k个受试者、第i种顺序,在第j个周期、第t种制剂所观测的实验效应;
μ为总的平均效应;Ƴi为顺序的固定效应;Sk(i)为第k个受试对象在第i个顺序中的随机效应;πj为第j个周期的固定效应;σt为第t种制剂的固定效应;εijtk为Yijtk的残差,为随机误差。
大串公式记不住,可以口语化的记为:
Y =平均值+贯序+受试者(贯序)+周期+制剂+个体内变异
Phoenix WinNonlin中统计学模型的显示:
在使用Phoenix WinNonlin的BE对象进行数据分析时,当我们完成数据映射后,它就会自动给出适用于该数据的统计模型,我们可以在它的固定效应和随机效应选项面板中,查看它使用的统计模型,如图是进行2×2生物等效性试验的面板截图:

大家可能注意到截图中的模型并不完整,这是因为Phoenix的固定效应默认是包含截距(平均值),随机效应默认包含随机误差,所以这两项作为默认设定无需额外输入。
BE对象的结果列表:
在执行BE对象后,我们可以得到如下结果列表:

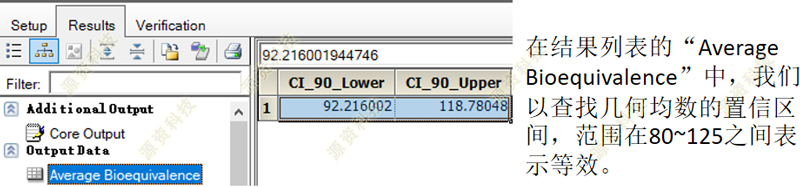
生物等效性的计算最终结果,我们可以在“Average Bioequivalence”报表中查看得到,而高亮标黄的表格是一些我们可能感兴趣的中间结果报表,而剩余未标记的报表,可以辅助我们的生物统计学家对结果做进一步的判断。
下面我们逐一的来查看下这几个主要报表,
Final Fixed Parameters报表:
报告统计学模型中固定效应的估计值、标准误、自由度、T值、P值等一些的相关结果。

Final Variance Parameters报表:
报告统计学模型中随机效应的估计值,同时也会报告大家比较关注的个体内变异(Intrasubject CV)和个体间变异(Intersubject CV)。

Least Squares Means和LSM Differences报表:
报告参比制剂、受试制剂和参比制剂与受试制剂差值的估计值、标准误、自由度等一系列参数。

到此,通过上述报表我们得到了几个直接参数:μR,μT,SμR-μT(差值的标准误),Intrasubject CV(个体内变异)等参数。
双单侧T检验:
使用上述以求得的参数,带入到如下图所示的双单侧T检验的公式中,我们便可求得t1、t2的值,接着可进一步求得T值所对应的P值;当两个P值都小于0.05时,我们认为生物等效。
这些结果都会被罗列在“Average Bioequivalence”工作表中。

90%置信区间:
90%置信区间法表示展示的等效性结果,是大家最喜欢看的一种方式,它的求算过程与双单侧T检验一样,我们带入相关公式即可求出。
自然对数尺度下90%置信区间上限与下限计算公式:
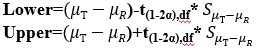
将上式的结果,带入下述公式即可求得常数尺度下的90%置信区间上限与下限:
• CI_Lower = 100* exp(Lower)
• CI_Upper = 100* exp(Upper)
到此,我们就得到了常见的80%-125%的置信区间结果,在“Average Bioequivalence”工作表中,置信区间的计算结果也罗列在其中。
总结:
在Phoenix WInNonlin生等效性对象的结果列表中,我们可直接通过“Average Bioequivalence”报表,获得生物等效性的结果,包括双单侧T检验结果、90%置信区间结果、受试制剂与参比制剂的平均值、参比制剂与受试制剂的比值、参比制剂与受试制剂的差值的标准误等一系列丰富的结果,在Final Variance Parameters报表中获得参数——个体内变异(Intrasubject CV)。
以上就是Phoenix WinNonlin生物等效性对象的2×2×2实验设计平均生物等效性结果的说明,如有什么疑问欢迎到近期Phoenix WinNonlin培训班中与我现场交流!
参考文献:
《Phoenix WinNonlin User's Guide》
《FDA生物等效性标准》
柳再华, 陈汇, 刘建华. 等效性研究的常用统计分析方法及其评价[J]. 数理医药学杂志, 2003, 16(5):391-394.




